第19章 遷移金属と配位化学

図19.1 | 遷移金属はしばしば鮮やかな色の錯体を形成します。孔雀石(緑色)、藍銅鉱(青色)、淡紅銀鉱(赤色)などの鉱物がその例です。(credit left: modification of work by James St. John; credit middle: modification of work by Stephanie Clifford; credit right: modification of work by Terry Wallace)
この章の概要
19.1 遷移金属とその化合物の産出・調製・性質
19.2 遷移金属の配位化学
19.3 配位化合物の分光学的・磁気的性質
はじめに
私たちは日常的に多くの遷移金属と接しています。鉄は、らせん綴じノートのリングやキッチンの刃物から、自動車、船舶、ビル、そしてあなたの血液中のヘモグロビンに至るまで、あらゆる場所に存在しています。チタンは、自転車のフレーム、人工股関節、宝飾品など、軽量で耐久性のある製品の製造に役立っています。クロムは、配管設備の保護めっきや自動車の細部の装飾に使用されています。
純粋な元素の形で使用されるだけでなく、遷移金属を含む多くの化合物は、他の無数の用途を有しています。硝酸銀は鏡を作るために使用され、ケイ酸ジルコニウムは自動車のブレーキに摩擦を与え、薬剤シスプラチンやその関連種のような多くの重要ながん治療薬は白金化合物です。
遷移金属が示すさまざまな性質は、それらの複雑な原子価殻によるものです。通常、1つの酸化状態が観察されるほとんどの主族金属とは異なり、遷移金属の原子価殻構造の結果として、通常、いくつかの異なる安定な酸化状態が発生します。さらに、これらの元素の電子遷移は可視電磁スペクトルの光子の吸収に対応しており、着色された化合物が得られます。これらの振る舞いのため、遷移金属は豊かで魅力的な化学的性質を示します。
19.1 遷移金属とその化合物の産出・調製・性質
遷移金属は、部分的に満たされたd軌道を持つ(または、それを容易に形成する)元素として定義されます。図19.2に示されるように、第3~11族のdブロック元素が遷移金属です。内部遷移金属(ランタニドやアクチニド)とも呼ばれるfブロック元素も、d軌道がf軌道よりも先に部分的に満たされるため、この基準を満たしています。銅族(第11族)ではd軌道が満たされています。この理由のため、次の族(第12族)は厳密には遷移元素ではありません。しかしながら、第12族の元素は同じ化学的性質のいくつかを示し、遷移金属の議論の中に一般に含まれています。化学者の中には、第12族元素を遷移金属として扱う人もいます。
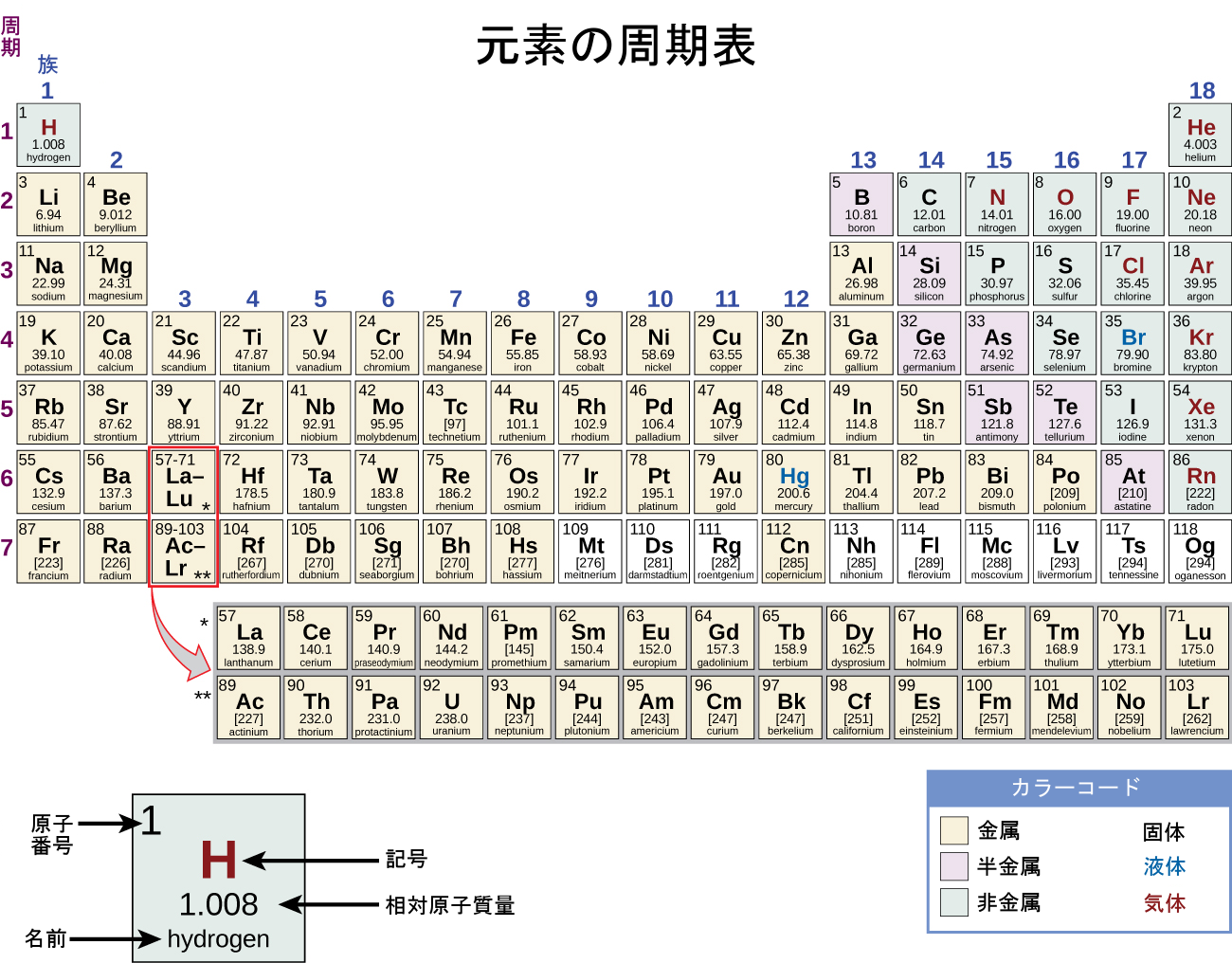
図19.2 | 遷移金属は周期表の第3~11族に位置しています。内部遷移金属は、周期表の本体の下の2行にあります。
dブロック元素は、第一遷移系列(元素Sc~Cu)、第二遷移系列(元素Y~Ag)、第三遷移系列(元素Laと元素Hf~Au)に分かれています。アクチニウムAcは、第四遷移系列の最初のメンバーであり、第四遷移系列は元素Rf~Rgも含みます。
fブロック元素は、ランタニド系列(またはランタノイド系列)を構成する元素Ce~Luと、アクチニド系列(またはアクチノイド系列)を構成する元素Th~Lrです。ランタンはランタニド元素と非常によく似た振る舞いをするため、その電子配置から第三遷移系列の最初のメンバーであるにもかかわらず、ランタニド元素と見なされています。同様に、アクチニウムはその電子配置から第四遷移系列の最初のメンバーであるにもかかわらず、アクチニウムの振る舞いの結果としてアクチニド系列の一部となります。
例題19.1 遷移金属の価電子
元素の電子構造と周期的性質に関する章で取り上げた電子配置の書き方を復習してください。遷移金属や内部遷移金属については、d電子やf電子の前にs電子を取り除く必要があることを思い出してください。その後で、それぞれのイオンについて、電子配置を示してください:
(a)セリウム(III)
(b)鉛(II)
(c)Ti²⁺
(d)Am³⁺
(e)Pd²⁺
遷移金属である例について、それらがどの系列に属するかを決定してください。
解法
イオンの場合、s価電子はd電子やf電子よりも先に失われます。
(a)Ce³⁺:[Xe]4f¹:Ce³⁺はランタニド系列の内部遷移元素です。
(b)Pb²⁺:[Xe]6s²5d¹⁰4f¹⁴:p軌道から電子を失います。これは主族元素です。
(c)チタン(II):[Ar]3d²; 第一遷移系列
(d)アメリシウム(III):[Rn]5f⁶:アクチニド
(e)パラジウム(II):[Kr]4d⁸:第二遷移系列
学習内容の確認
d電子を持たない第一遷移系列のイオンの一例を挙げてください。
解答:V⁵⁺が1つの可能性です。他の例としては、Sc³⁺、Ti⁴⁺、Cr⁶⁺、Mn⁷⁺などがあります。
日常生活の中の化学
ランタニドの機器への使用
ランタニド(57~71番の元素)は、歴史的に希土類元素としての特徴を持っているにもかかわらず、地殻中にかなり豊富に存在します。自然に存在する最も希少なランタノイドであるツリウムは、地殻中では銀よりもありふれています(質量比で、ツリウムは4.5×10⁻⁵%、銀は0.79×10⁻⁵%)。希土類元素は、15種類のランタノイドにスカンジウムとイットリウムを加えた17種類あります。希土類元素と呼ばれるのは、かつては抽出することが経済的に困難であったため、純粋な試料を得ることが稀だったからです。化学的性質が類似しているため、1つのランタニドを他のものから分離することは困難です。しかしながら、家庭用の硬水軟化装置に使われているものと同様のイオン交換樹脂のような新しい分離方法により、これらの元素がより簡単に、かつ経済的に分離できるようになりました。これらの元素を含むほとんどの鉱石は、低濃度で混合されたすべての希土類元素を持っています。
ランタニドの商業的用途は急速に拡大しています。たとえば、ユーロピウムは、コンピュータのモニター、携帯電話、テレビに使用されているフラットスクリーンディスプレイにおいて重要な役割を果たしています。ネオジムは、ラップトップ型パソコンのハードドライブや原油をガソリンに変換するプロセスで有用です(図19.3)。ホルミウムは歯科機器や医療機器に含まれています。さらに、多くの代替エネルギー技術はランタノイドに大きく依存しています。ネオジムとジスプロシウムは、ハイブリッド車のエンジンや、風力タービンに使用される磁石の主要成分です。

図19.3 | (a)ユーロピウムは、テレビ、コンピュータのモニター、携帯電話のディスプレイ画面に使用されています。(b)ネオジム磁石はコンピュータのハードドライブの中に一般的に見られます。(credit b: modification of work by “KUERT Datenrettung”/Flickr)
ランタニド材料の需要が供給よりも早く増加しているため、価格も上昇しています。2008年には、ジスプロシウムの価格は110ドル/kgでしたが、2014年には470ドル/kgにまで上昇しました。ランタノイド元素の供給量を増やすことは、これらの材料の光学的・磁気的性質に依存する産業が直面している最も重要な課題の1つです。
遷移元素は、他の金属と共通する多くの性質を持っています。遷移元素はほとんどすべてが硬く、高融点の固体で、熱や電気をよく伝導します。それらは容易に合金を形成し、電子を失って安定なカチオンを形成します。さらに、遷移金属は、多種多様な安定な配位化合物を形成します。その中では、中心の金属原子またはイオンがルイス酸として作用し、1つかそれ以上の電子対を受け入れます。多くの異なる分子やイオンが中心の金属に孤立電子対を供与し、ルイス塩基の役割を果たします。この章では、私たちは主として第一遷移系列の元素の化学的な振る舞いに焦点を当てます。
遷移元素の性質
遷移金属は幅広い化学的な振る舞いを示します。それらの還元電位(付録H参照)からわかるように、いくつかの遷移金属は強い還元剤である一方で、他の遷移金属は非常に低い反応性を有します。たとえば、ランタニドはすべて安定な3+水溶性カチオンを形成します。このような酸化の駆動力は、BeやMgのようなアルカリ土類金属がBe²⁺やMg²⁺を形成するときのものと似ています。一方、白金や金のような物質は、はるかに高い還元電位を持っています。それらは酸化に対抗する能力を持っていることから、回路や宝飾品を作り出すための材料として有用です。
Cr³⁺、Fe³⁺、Co²⁺などの軽いdブロック元素のイオンは、水の中で安定な色とりどりの水和イオンを形成します。しかしながら、これらのすぐ下の周期のイオン(Mo³⁺、Ru³⁺、Ir²⁺)は不安定で、空気中の酸素と容易に反応します。重いdブロック元素によって形成される単純で水の中で安定なイオンの大部分は、MoO₄²⁻やReO₄⁻のようなオキシアニオンです。
ルテニウム、オスミウム、ロジウム、イリジウム、パラジウム、白金は白金族金属です。それらは(難しいですが)水中で安定な単純なカチオンを形成し、第二および第三遷移系列の前のほうの元素とは異なり、安定なオキシアニオンは形成しません。
dブロックおよびfブロック元素はいずれも非金属と反応して二元化合物を形成しますが、しばしば加熱を必要とします。これらの元素はハロゲンと反応して、1+から6+までの酸化状態のさまざまなハロゲン化物を形成します。加熱すると、酸素はパラジウム、白金、銀、金を除くすべての遷移元素と反応します。これらの後者の金属の酸化物は、他の反応物を用いて形成することができますが、加熱すると分解します。fブロック元素、第3族元素、および銅を除く第一遷移系列の元素は、酸の水溶液と反応して水素気体や対応する塩の水溶液を形成します。
遷移金属は、幅広い酸化状態を持つ化合物を形成することができます。第一遷移系列の元素で観測された酸化状態のいくつかが、図19.4に示されています。第一遷移系列を左から右に移動すると、一般的な酸化状態の数が最初は増加し、表の中央に向かって最大になり、その後減少していることがわかります。表中の値は典型的な値です。他にも既知の値があり、新たな追加物を合成することも可能です。たとえば、2014年に研究者はイリジウムの新しい酸化状態(9+)の合成に成功しました。
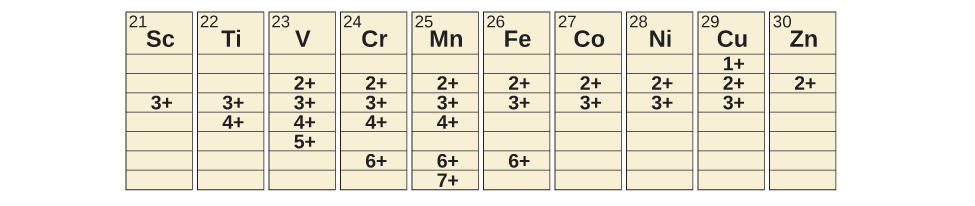
図19.4 | 第一遷移系列の遷移金属は、さまざまな酸化状態を伴う化合物を形成することができます。
スカンジウムからマンガンまでの元素(第一遷移系列の前半)では、最高の酸化状態は、それらの原子価殻のs軌道とd軌道の両方ですべての電子が失われることに対応しています。たとえば、チタン(IV)イオンは、チタン原子が2つの3d電子と2つの4s電子を失ったときに形成されます。これらの最高の酸化状態は、スカンジウム、チタン、バナジウムの最も安定な形態です。しかしながら、私たちがこの系列をたどっていくにあたって、金属からすべての価電子を除去し続けることはできません。鉄は2+から6+までの酸化状態を形成することが知られており、鉄(II)と鉄(III)が最も一般的です。第一遷移系列の元素のほとんどは、水の中で安定な2+または3+の電荷を持つイオンを形成しますが、この系列の最初のほうの元素は空気によって容易に酸化されます。
第二および第三遷移系列の元素は、一般に第一遷移系列の元素よりも高い酸化状態でより安定しています。一般的に、ある族を下がるにつれて原子半径が大きくなると、第二および第三遷移系列のイオンは第一遷移系列のイオンよりも大きくなります。原子核から離れた位置にある軌道から電子を取り除くことは、原子核の近くにある電子を取り除くよりも簡単です。たとえば、第6族のメンバーであるモリブデンとタングステンは、水溶液中で6+の酸化状態にほとんど制限されています。この族の中で最も軽いメンバーであるクロムは、水中では安定なCr³⁺イオンを形成し、空気がない場合には、より安定でないCr²⁺イオンを形成します。クロムの酸化状態が最も高い硫化物は、Cr³⁺イオンを含むCr₂S₃です。モリブデンとタングステンは、これらの金属が4+と6+の酸化状態を示すような硫化物を形成します。
例題19.2 遷移金属の活性
クロム(VI)を含む重クロム酸イオン、マンガン(VII)を含む過マンガン酸イオン、チタン(IV)を含む二酸化チタンのうち、酸性溶液中で最も強い酸化剤はどれですか?
解法
私たちはまず、指定された酸化状態のそれぞれの酸化物について、還元半反応を(付録Lで)調べる必要があります:
\[ {\rm {Cr_2 O_7}^{2−} + 14H^+ + 6e^− ⟶ 2Cr^{3+} + 7H_2 O \hspace{20pt} +1.33\ V}\\ {\rm {MnO_4}^− + 8H^+ + 5e^− ⟶ Mn^{2+} + H_2 O \hspace{20pt} +1.51\ V}\\ {\rm TiO_2 + 4H^+ + 2e^− ⟶ Ti^{2+} + 2H_2 O \hspace{20pt} −0.50\ V}\\ \]
還元電位が大きいということは、反応物を還元しやすいということを意味します。還元電位が最も大きい過マンガン酸イオンは、これらの条件下で最も強い酸化剤です。次に重クロム酸イオン、次に二酸化チタンがこの組の中で最も弱い(最も還元しにくい)酸化剤として続きます。
学習内容の確認
HClとCo(s)の間、および、HBrとPt(s)の間でどのような反応が起こるか(もし起こるとして)を予測してください。あなたは、付録Lの標準還元電位を使用する必要があるでしょう。
解答:Co(s) + 2HCl ⟶ H₂ + CoCl₂(aq)、Pt(s)はH⁺によって酸化されないので反応は起こりません。
遷移元素の調製
いくつかの古代の文明は、鉄、銅、銀、および金について知っていました。人類の歴史の中で青銅器時代と鉄器時代として知られている期間は、社会が特定の金属を単離して道具や製品を作るためにそれらを使用することを学んだ進歩を指し示しています。自然に存在する銅、銀、金の鉱石は、これらの金属を元素の形態で高濃度に含んでいることがあります(図19.5)。一方、鉄は、ほぼすべての場合で、錆(Fe₂O₃)のような酸化した形態で地球上に存在しています。既知の最も古い鉄製の道具は、鉄の隕石から作られたものです。紀元前4000年から2500年頃までさかのぼる鉄の人工物が現存することは稀であり、既知のすべての例には、地球上ではなく、地球外の物体にのみ存在する鉄とニッケルの特定の合金が含まれています。文明が鉄の製錬(自然界に存在する鉱石から純粋な元素を抽出する能力)を開発し、鉄の道具が一般的になるまでには、何千年もの技術進歩が必要でした。

図19.5 | 遷移金属は自然界にさまざまな形態で存在します。例としては、(a)銅のナゲット、(b)金の埋蔵物、(c)酸化した鉄を含む鉱石などが挙げられます。(credit a: modification of work by http://images-of-elements.com/copper-2.jpg; credit c: modification of work by http://images-of-elements.com/iron-ore.jpg)
一般に遷移元素は、さまざまな鉱石に含まれる鉱物から抽出されます。しかしながら、その回収のしやすさは、鉱石中の元素の濃度、存在する他の元素の種類、元素を遊離金属へと還元することの難しさなどによって大きく異なります。
一般に、dブロック元素のイオンを遊離元素に還元することは難しくはありません。炭素は、ほとんどの場合では、十分に強い還元剤です。しかしながら、fブロック元素のイオンは、より活性の高い主族金属のイオンと同様に、電気分解によって、あるいはカルシウムなどの活性金属で還元することによって単離されなければなりません。
私たちは、鉄、銅、および銀の単離に用いられるプロセスについて議論します。なぜなら、これらの3つのプロセスは、ほとんどのdブロック金属を単離するための主要な手段を示しているからです。一般的には、これらのプロセスはどれも、予備処理、製錬、精錬の3つの主要な段階を含みます。
予備処理。一般的には、鉱石を金属の抽出に適した形にするための初期処理があります。これには通常、鉱石を破砕または粉砕し、金属を含む部分を選鉱し、時にはこれらの物質を化学的に処理して金属に還元しやすい化合物に変換することもあります。
製錬。次の段階は、溶融状態の金属を抽出することで、製錬と呼ばれる工程です。これには、金属化合物を金属に還元することが含まれます。不純物は、スラグ(溶融金属から容易に分離することのできるような低融点の物質)を形成するような化合物の添加により除去することができます。
精錬。金属の回収の最終段階は、金属を精錬することです。亜鉛や水銀などの低沸点金属は蒸留により精錬することができます。スズのような低融点金属は、傾斜したテーブルの上で溶けると流れ出して、より高い融点の不純物から離れていきます。電気分解も金属を精錬するための一般的な方法です。
鉄の単離
鉄を工具や武器の製造という初期の用途に利用することが可能であったのは、鉄鉱石が広く分布していたことと、鉄鉱石中の鉄化合物を炭素によって簡単に還元することができたからです。長い間、還元過程で使用される炭素の形態は木炭でした。鉄の生産と使用は、還元剤としてコークスが導入された1620年頃からはるかに普及するようになりました。コークスとは、空気のないところで石炭を加熱して不純物を除去することによって形成された炭素の形態のことです。
鉄の冶金の第一段階では、通常、鉱石を焙焼(鉱石を空気中で加熱)して水分を除去し、炭酸塩を分解して酸化物にし、そして硫化物を酸化物に変換します。次に、酸化物は高さ80~100フィート、直径約25フィートの高炉(図19.6)の中で還元されます。高炉の中には焙焼された鉱石、コークス、石灰岩(不純なCaCO₃)が連続的に上部へと投入されます。溶融した鉄とスラグは底部で引き出されます。炉内の金属材料全体の重量は数百トンにもなります。
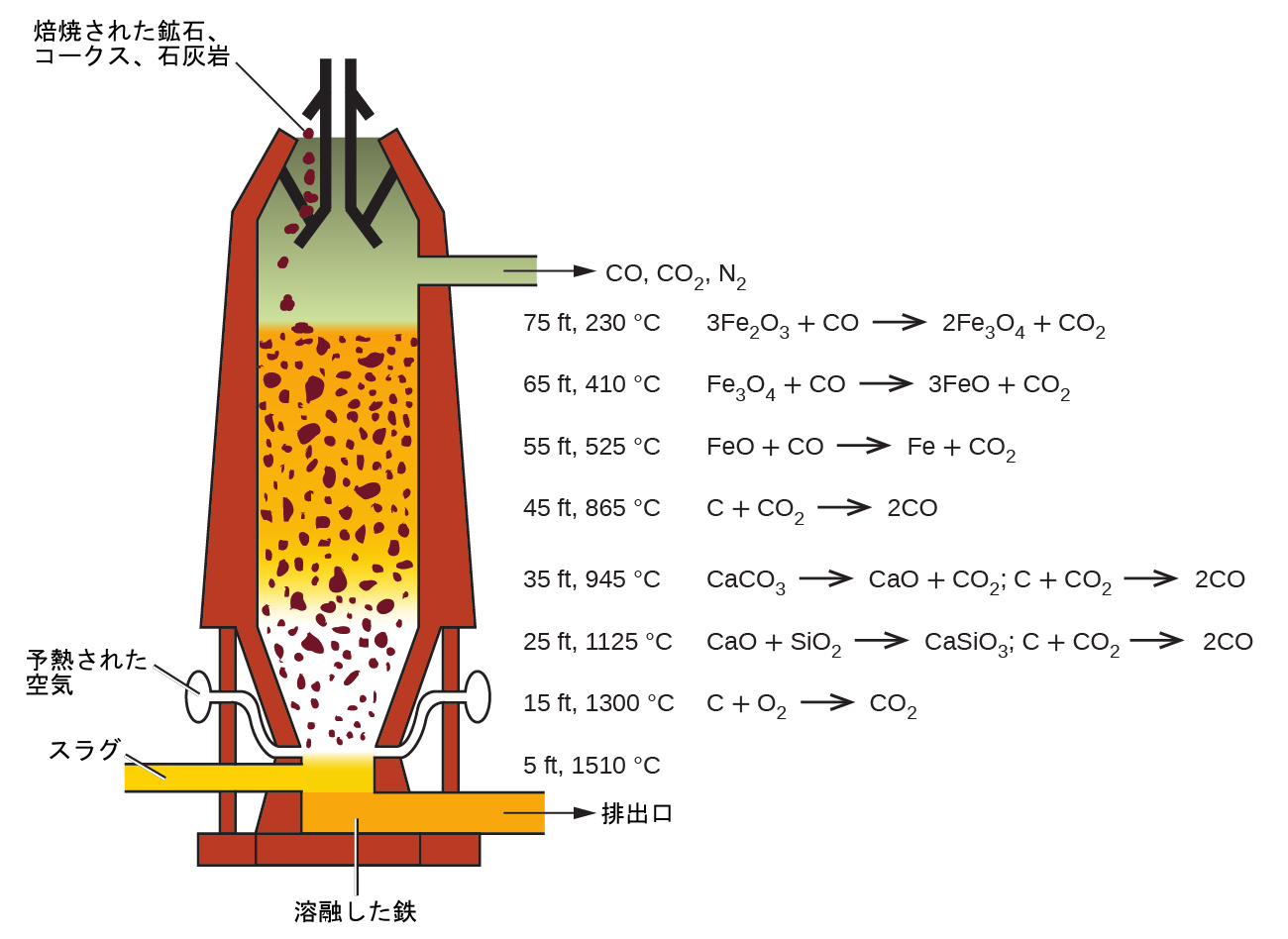
図19.6 | 高炉内では、異なる温度帯で異なる反応が生じます。一酸化炭素はより高温の底部で発生し、上方に上昇して、上部で起こる一連の反応を通じて鉄酸化物を純粋な鉄に還元します。
炉の底部近くにはノズルがあり、そこを通して予熱された空気が炉内に吹き込まれます。空気が入るとすぐに、ノズルの領域のコークスは二酸化炭素に酸化されて、大量の熱を放出します。高温の二酸化炭素は、上層にある白熱したコークスを通過して一酸化炭素に還元され、上へと向かいます:
\[ {\rm CO_2\ (g) + C\ (s) ⟶ 2CO\ (g)}\\ \]
炉の上部領域では一酸化炭素が還元剤として機能します。個々の反応は図19.6に示されています。
炉の上部領域では鉄酸化物が還元されます。中間領域では、石灰岩(炭酸カルシウム)が分解し、得られた酸化カルシウムが鉱石中のシリカやケイ酸塩と結合してスラグを形成します。このスラグはほとんどがケイ酸カルシウムであり、鉱石の商業的に重要でない成分のほとんどを含んでいます:
\[ {\rm CaO\ (s) + SiO_2\ (s) ⟶ CaSiO_3\ (l)}\\ \]
炉の中央部のすぐ下は、鉄とスラグの両方を溶かすのに十分な高温になっています。鉄とスラグは炉の底部に層状に集まり、密度の低いスラグは鉄の上に浮いて鉄を酸化から守ります。1日に数回、スラグと溶融した鉄が炉から引き出されます。鉄は鋳造機や製鋼所に運ばれます(図19.7)。

図19.7 | 溶融した鉄が鉄鋼として鋳造されている様子が示されています。(credit: Clint Budd)
生産された鉄の多くは、精錬されて鉄鋼に変換されます。鉄鋼は鉄から不純物を取り除き、マンガン、クロム、ニッケル、タングステン、モリブデン、バナジウムなどの物質を加えることによって作られ、特定の用途に適した材料特性を持つ合金を製造します。ほとんどの鉄鋼はまた、小さいものの明確な割合(0.04%~2.5%)の炭素を含んでいます。しかしながら、鉄に含まれる炭素の大部分は、鉄鋼の製造時に除去しなければなりません。さもなければ、過剰な炭素は鉄を脆くしてしまうでしょう。
学習へのリンク
あなたは、製鋼のアニメーション(http://openstaxcollege.org/l/16steelmaking)で、プロセスを順番に見ていくことができます。
銅の単離
銅の最も重要な鉱石は硫化銅(銅藍CuSなど)を含んでいますが、酸化銅(黒銅鉱CuOなど)や炭酸水酸化銅(孔雀石Cu₂(OH)₂CO₃など)が見つかることもあります。金属銅の製造では、選鉱された硫化鉱を焙焼して硫黄の一部を二酸化硫黄として除去します。残りの混合物(Cu₂S、FeS、FeO、SiO₂からなります)は、フラックス(不純物の除去を助ける物質)である石灰岩と混合されて、加熱されます。ルイス酸-塩基反応により鉄とシリカが除去され、溶融スラグが形成されます:
\[ {\rm CaCO_3\ (s) + SiO_2\ (s) ⟶ CaSiO_3\ (l) + CO_2\ (g)}\\ {\rm FeO\ (s) + SiO_2\ (s) ⟶ FeSiO_3\ (l)}\\ \]
この反応では、二酸化ケイ素はルイス酸として振る舞い、ルイス塩基(酸化物イオン)から一対の電子を受け入れます。
製錬後に残るCu₂Sの還元は、溶融した材料に空気を吹き込むことで行われます。空気はCu₂Sの一部をCu₂Oに変換します。酸化銅(I)が形成されるとすぐに、それは残った硫化銅(I)によって還元されて金属銅になります:
\[ {\rm 2Cu_2 S\ (l) + 3O_2\ (g) ⟶ 2Cu_2 O\ (l) + 2SO_2\ (g)}\\ {\rm 2Cu_2 O\ (l) + Cu_2 S\ (l) ⟶ 6Cu\ (l) + SO_2\ (g)}\\ \]
このようにして得られた銅は、その特徴的な外観から粗銅(ブリスター銅)と呼ばれています(図19.8)。その外観は、そこに含まれる気泡(ブリスター)によるものです。この不純な銅は大きな板へと鋳造され、それがこの金属の電解精錬(電気化学の章で記述されています)のアノードとして使用されます。

図19.8 | 粗銅は、銅を含む鉱石を純粋な銅に変換する過程で得られます。(credit: “Tortie tude”/Wikimedia Commons)
銀の単離
銀は大きなナゲット(図19.9)に含まれることもありますが、より頻繁には鉱脈や関連する鉱床に含まれることが多いです。かつては、掬い取りが銀と金の両方のナゲットを単離する効果的な方法でした。それらは反応性が低いため、これらの金属(と他のいくつかの金属)は、ナゲットとして鉱床に存在しています。白金の発見は、中央アメリカでスペイン人探検家が白金ナゲットを銀と間違えたことによるものです。金属がナゲットの形をしていない場合、その鉱石から銀を分離するために、湿式精錬と呼ばれるプロセスを採用することがしばしば有用です。湿式精錬では、まず金属を可溶性イオンに変換し、次にそれらを抽出・還元して純粋な金属を沈殿させることによって、混合物から金属を分離します。空気の存在下では、金属銀またはAg₂SやAgClなどの銀含有化合物から、アルカリ金属のシアン化物が可溶性のジシアニド銀(I)酸イオン[Ag(CN)₂]⁻を容易に形成します。代表的な反応式は以下の通りです:
\[ {\rm 4Ag\ (s) + 8CN^−\ (aq) + O_2\ (g) + 2H_2 O\ (l) ⟶ 4 [Ag(CN)_2]^−\ (aq) + 4OH^−\ (aq)}\\ {\rm 2Ag_2 S\ (s) + 8CN^−\ (aq) + O_2\ (g) + 2H_2 O\ (l) ⟶ 4 [Ag(CN)_2]^−\ (aq) + 2S\ (s) + 4OH^−\ (aq)}\\ {\rm AgCl\ (s) + 2CN^−\ (aq) ⟶ [Ag(CN)_2]^−\ (aq) + Cl^−\ (aq)}\\ \]

図19.9 | 天然に存在する遊離銀は、ナゲット(a)として、または鉱脈(b)で発見されることがあります。(credit a: modification of work by “Teravolt”/Wikimedia Commons; credit b: modification of work by James St. John)
還元剤となる亜鉛イオンまたは鉄(II)イオンのいずれかを加えることにより、シアン化物溶液から銀が析出します:
\[ {\rm 2 [Ag(CN)_2]^−\ (aq) + Zn\ (s) ⟶ 2Ag\ (s) + [Zn(CN)_4]^{2−}\ (aq)}\\ \]
例題19.3 精錬の際の酸化-還元
銀を精錬する段階の1つに、銀をジシアニド銀(I)酸イオンに変換することがあります:
\[ {\rm 4Ag\ (s) + 8CN^−\ (aq) + O_2\ (g) + 2H_2 O\ (l) ⟶ 4 [Ag(CN)_2]^−\ (aq) + 4OH^−\ (aq)}\\ \]
この反応を実行するためには酸素が存在しなければならない理由を説明してください。なぜこの反応は以下のようには起こらないのでしょうか?:
\[ {\rm 4Ag\ (s) + 8CN^−\ (aq) ⟶ 4 [Ag(CN)_2]^−\ (aq)}\\ \]
解法
原子と同じように電荷も反応の中でバランスを取らなければなりません。銀原子は0の酸化状態から1+の状態に酸化されています。何かが電子を失うときには、常に何かが電子を得て(還元されて)反応式のバランスを取らなければなりません。酸素は、電子を得て0の酸化状態から2-の酸化状態になることができるので、これらの反応に適した酸化剤です。
学習内容の確認
鉄を精錬する際には、高炉内に炭素が存在しなければなりません。なぜ、酸化鉄を鉄に変えるために炭素が必要なのでしょうか?
解答:炭素はCOに変換されます。これは電子を受け入れる還元剤であるため、鉄(III)を鉄(0)に還元することができます。
遷移金属化合物
遷移元素の単純な化合物における結合は、イオン性から共有結合性までの範囲にわたっています。遷移元素は、低い酸化状態ではイオン化合物を形成し、高い酸化状態では共有結合化合物や多原子イオンを形成します。遷移元素が示す酸化状態の変動は、これらの化合物に対して金属ベースの酸化-還元の化学的な性質を与えます。遷移系列の元素を含む化合物のいくつかの分類についての化学的性質は以下の通りです。
ハロゲン化物
それぞれの遷移元素の無水ハロゲン化物は、金属とハロゲンを直接反応させることにより調製することができます。たとえば:
\[ {\rm 2Fe\ (s) + 3Cl_2\ (g) ⟶ 2FeCl_3\ (s)}\\ \]
金属ハロゲン化物を追加の金属とともに加熱することにより、より酸化状態の低い金属を伴うハロゲン化物を形成することができます:
\[ {\rm Fe\ (s) + 2FeCl_3\ (s) ⟶ 3FeCl_2\ (s)}\\ \]
金属とハロゲンを反応させて得られる金属ハロゲン化物の化学量論は、金属とハロゲンの相対的な量、およびハロゲンの酸化剤としての強さによって決まります。一般に、フッ素は、その最も高い酸化状態の金属を含むフッ化物を形成します。他のハロゲンは類似の化合物を形成しない場合があります。
一般に、第一遷移系列の金属のハロゲン化物の安定な水溶液の調製は、炭酸塩、水酸化物、酸化物、または塩基性アニオンを含む他の化合物にハロゲン化水素酸を加えることによって行われます。反応例は以下の通りです:
\[ {\rm NiCO_3\ (s) + 2HF\ (aq) ⟶ NiF_2\ (aq) + H_2 O\ (l) + CO_2\ (g)}\\ {\rm Co(OH)_2\ (s) + 2HBr\ (aq) ⟶ CoBr_2\ (aq) + 2H_2 O\ (l)}\\ \]
また、第一遷移系列の金属のほとんどは、酸に溶解し、塩の溶液と水素気体を形成します。たとえば:
\[ {\rm Cr\ (s) + 2HCl\ (aq) ⟶ CrCl_2\ (aq) + H_2\ (g)}\\ \]
遷移金属との結合の極性は、関与する原子の電気陰性度だけでなく、遷移金属の酸化状態によっても変化します。結合の極性は連続的なスペクトルであり、一方の端部では電子が均等に共有され(共有結合)、他方の端部では電子が完全に移動される(イオン結合)、ということを思い出してください。どんな結合も100%イオン性であるということはなく、電子が均等に分配されている度合いが化合物の多くの性質を決定します。低い酸化数の遷移金属ハロゲン化物は、よりイオン性の結合を形成します。たとえば、塩化チタン(II)と塩化チタン(III)(TiCl₂とTiCl₃)は、イオン化合物に特徴的な高い融点を有していますが、塩化チタン(IV)(TiCl₄)は揮発性の液体であり、共有結合性のチタン-塩素結合を持っていることと一致しています。より重いdブロック元素のハロゲン化物はすべて顕著な共有結合的な性質を持っています。
より高い酸化状態を持つ遷移金属の共有結合的な振る舞いは、金属の四ハロゲン化物と水との反応によって例示されます。共有結合性の四塩化ケイ素と同様に、チタンとバナジウムの四ハロゲン化物も水と反応して、対応するハロゲン化水素酸と金属酸化物を含む溶液を生成します:
\[ {\rm SiCl_4\ (l) + 2H_2 O\ (l) ⟶ SiO_2\ (s) + 4HCl\ (aq)}\\ {\rm TiCl_4\ (l) + 2H_2 O\ (l) ⟶ TiO_2\ (s) + 4HCl\ (aq)}\\ \]
酸化物
ハロゲン化物と同様に、遷移元素の酸化物における結合の性質は、金属の酸化状態によって決まります。低い酸化状態を持つ酸化物はよりイオン性である傾向がある一方で、高い酸化状態を持つ酸化物はより共有結合性です。このような結合の違いは、元素の電気陰性度が固定された値ではないことによるものです。ある元素の電気陰性度は、酸化状態が高くなるほど高くなります。低い酸化状態の遷移金属は、酸素に比べて低い電気陰性度の値を有するため、それらの金属酸化物はイオン性となります。非常に高い酸化状態の遷移金属は、酸素に近い電気陰性度の値を有するため、それらの酸化物は共有結合性となります。
第一遷移系列の酸化物は、金属を空気中で加熱することにより調製することができます。これらの酸化物は、Sc₂O₃、TiO₂、V₂O₅、Cr₂O₃、Mn₃O₄、Fe₃O₄、Co₃O₄、NiO、およびCuOです。
あるいは、これらの酸化物および他の酸化物(異なる酸化状態の金属を有するもの)は、対応する水酸化物、炭酸塩、またはシュウ酸塩を不活性雰囲気中で加熱することによって調製することができます。酸化鉄(II)はシュウ酸鉄(II)を加熱することにより調製することができ、酸化コバルト(II)は水酸化コバルト(II)を加熱することにより製造することができます:
\[ {\rm FeC_2 O_4\ (s) ⟶ FeO\ (s) + CO\ (g) + CO_2\ (g)}\\ {\rm Co(OH)_2\ (s) ⟶ CoO\ (s) + H_2 O\ (g)}\\ \]
CrO₃とMn₂O₇を除いて、遷移金属酸化物は水に溶けません。それらは、酸や、いくつかの場合では塩基と反応します。全体として、酸化状態が最も低い遷移金属の酸化物は塩基性であり(酸と反応し)、中間的なものは両性であり、最も高い酸化状態のものは主として酸性です。低い酸化状態の塩基性金属酸化物は、水溶性の酸と反応して塩と水の溶液を形成します。例としては、酸化コバルト(II)が硝酸から陽子を受け取る反応と、酸化スカンジウム(III)が塩酸から陽子を受け取る反応が挙げられます:
\[ {\rm CoO\ (s) + 2HNO_3\ (aq) ⟶ Co(NO_3 )_2\ (aq) + H_2 O\ (l)}\\ {\rm Sc_2 O_3\ (s) + 6HCl\ (aq) ⟶ 2ScCl_3\ (aq) + 3H_2 O\ (l)}\\ \]
4+の酸化状態を持つ金属の酸化物は両性であり、ほとんどが酸にも塩基にも溶けません。酸化バナジウム(V)、酸化クロム(VI)、酸化マンガン(VII)は酸性です。それらは水酸化物の溶液と反応してオキシアニオンVO₄³⁻、CrO₄²⁻、およびMnO₄⁻の塩を形成します。たとえば、強塩基と酸化クロム(VI)の反応についての完全なイオン反応式は、以下のように与えられます:
\[ {\rm CrO_3\ (s) + 2Na^+\ (aq) + 2OH^−\ (aq) ⟶ 2Na^+\ (aq) + {CrO_4}^{2−}\ (aq) + H_2 O\ (l)}\\ \]
酸化クロム(VI)と酸化マンガン(VII)は水と反応して、それぞれ酸H₂CrO₄とHMnO₄を生成します。
水酸化物
第一遷移系列の遷移金属の塩の水溶液に可溶性の水酸化物を加えると、ゼラチン状の沈殿物が形成されます。たとえば、硫酸コバルトの水溶液に水酸化ナトリウムの水溶液を加えると、ピンク色または青色の水酸化コバルト(II)のゼラチン状の沈殿物が生成します。正味イオン反応式は以下の通りです:
\[ {\rm Co^{2+}\ (aq) + 2OH^−\ (aq) ⟶ Co(OH)_2\ (s)}\\ \]
この場合および他の多くの場合において、これらの沈殿物は、遷移金属イオン、水酸化物イオン、および遷移金属に配位した水を含む水酸化物です。他の場合には、この沈殿物は、金属イオン、酸化物イオン、および水和物水からなる水和酸化物です:
\[ {\rm 4Fe^{3+}\ (aq) + 6OH^−\ (aq) + n H_2 O\ (l) ⟶ 2Fe_2 O_3 ·(n + 3)H_2 O\ (s)}\\ \]
これらの物質には水酸化物イオンは含まれていません。しかしながら、水酸化物と水和酸化物はどちらも酸と反応して塩と水を形成します。溶液から金属を沈殿させる場合、水酸化物イオンが過剰にならないようにする必要があります。なぜなら、それは、この章で後述するように錯イオンの形成につながることがあるからです。沈殿した金属水酸化物は、さらなる処理や廃棄物処理のために分離することができます。
炭酸塩
第一遷移系列の元素の多くは、不溶性の炭酸塩を形成します。これらの炭酸塩は、遷移金属塩の溶液に可溶性炭酸塩を加えることにより調製することができます。たとえば、炭酸ニッケルは、以下の正味イオン反応式に従って、硝酸ニッケルと炭酸ナトリウムの溶液から調製することができます:
\[ {\rm Ni^{2+}\ (aq) + {CO_3}^{2−} ⟶ NiCO_3\ (s)}\\ \]
遷移金属の炭酸塩の反応は、活性金属の炭酸塩の反応に似ています。それらは酸と反応して金属塩、二酸化炭素、水を生成します。加熱するとそれらは分解して遷移金属酸化物を形成します。
その他の塩
多くの点で、第一遷移系列の元素の化学的な振る舞いは、主族金属のそれと非常に類似しています。特に、主族金属の塩を調製するために使用されるのと同じタイプの反応を用いて、これらの元素の単純なイオン性の塩を調製することができます。
水素よりも活性の高い金属と対応する酸との反応により、さまざまな塩を調製することができます:金属のスカンジウムは、臭化水素酸と反応して臭化スカンジウムの溶液を形成します:
\[ {\rm 2Sc\ (s) + 6HBr\ (aq) ⟶ 2ScBr_3\ (aq) + 3H_2\ (g)}\\ \]
先ほど議論した一般的な化合物も、塩の調製に使用することができます。関係する反応としては、酸化物、水酸化物、または炭酸塩と酸との反応が含まれます。たとえば:
\[ {\rm Ni(OH)_2\ (s) + 2H_3 O^+\ (aq) + {2ClO_4}^−\ (aq) ⟶ Ni^{2+}\ (aq) + {2ClO_4}^−\ (aq) + 4H_2 O\ (l)}\\ \]
不溶性の塩を調製するためには、可溶性の塩を含む置換反応を用いてもよいです。たとえば:
\[ {\rm Ba^{2+}\ (aq) + 2Cl^−\ (aq) + 2K^+\ (aq) + {CrO_4}^{2−}\ (aq) ⟶ BaCrO_4\ (s) + 2K^+\ (aq) + 2Cl^−\ (aq)}\\ \]
この節における酸化物についての私たちの議論では、遷移元素の共有結合の酸化物と水酸化物が反応して、遷移元素のオキシアニオンを含む塩を形成することを見てきました。
さまざまな科学のつながり
高温超伝導体
超伝導体とは、抵抗なしに電気を通す物質のことです。抵抗がないということは、電気を送る際にエネルギーの損失がないということを意味します。これにより、電気のコストの大幅な削減へとつながるでしょう。
現在使用されている、市販の超伝導物質(NbTiやNb₃Snなど)のほとんどは、23K(-250°C)以下に冷却しないと超伝導になりません。超伝導になるには、沸騰温度が4Kで、高価な、扱いの難しい液体ヘリウムを使用する必要があります。液体ヘリウムのコストが、超伝導体の広範な使用を妨げています。
1980年代の最もエキサイティングな科学的発見の1つは、90K以上の温度で超伝導性を示す化合物の特徴が調べられたことです。(液体ヘリウムに比べると、90Kは高温です。)高温超伝導物質の代表的なものとしては、イットリウム(またはいくつかの希土類元素のうちの1つ)、バリウム、銅を1:2:3の割合で含む酸化物があります。イオン性イットリウム化合物の化学式はYBa₂Cu₃O₇です。
この新しい物質は、液体窒素(沸騰温度77K)での冷却によって到達することのできる温度である90K(図19.10)に近い温度で超伝導になります。液体窒素で冷却した材料は取り扱いが容易なだけでなく、冷却コストも液体ヘリウムの約1000分の1に抑えられます。
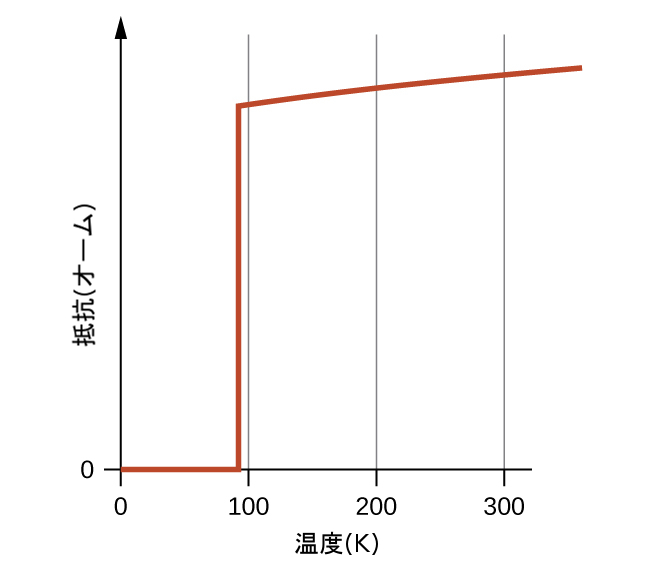
図19.10 | 高温超伝導体YBa₂Cu₃O₇の抵抗値は温度によって変化します。この物質が超伝導になる92K未満では抵抗値がゼロになることに注目してください。
これらの材料の脆くて壊れやすいという性質は、現在のところ商業的な実用化に向けた妨げとなっていますが、それらは非常に大きな可能性を秘めており、研究者たちはその実現に向けてプロセスの改善に取り組んでいます。超伝導送電線は、電線の抵抗による電力の損失なしに、何百マイルにもわたって電流を流すことができるでしょう。これにより、人口集中地から離れた地域や、電力生産に必要な天然資源の近くに発電所を設置することが可能になるでしょう。2008年にニューヨークで、高温超伝導送電の実行可能性を実証するための最初のプロジェクトが設立されました。
研究者たちは、この技術を利用して、より小型で強力なマイクロチップなどの他の用途の開発にも取り組んでいます。さらに、高温超伝導体は、医療機器、磁気浮上式列車、核融合炉の閉じ込め磁場などの用途で磁場を発生させるために使用することができます(図19.11)。

図19.11 | (a)磁気浮上式列車(マグレブ)は、線路に沿って動かすために超伝導技術を利用しています。(b)このような皿を超伝導体として使って磁石を浮上させることができます。(credit a: modification of work by Alex Needham; credit b: modification of work by Kevin Jarrett)
学習へのリンク
高温超伝導体(http://openstaxcollege.org/l/16supercond)が磁気レーストラックの周りを浮遊する様子をこのビデオで見てください。
19.2 遷移金属の配位化学
この節が終わるまでに、あなたは次のことができるようになります:
•配位化合物を決定づける特性を列挙する
•単座配位子と多座配位子を含む錯体の構造を記述する
•標準的な命名規則を使用して、配位化合物に名前を付ける
•幾何異性と光学異性を説明し、例を挙げる
•配位化合物の自然での産出および技術的な生成をいくつか特定する
あなたの血液中のヘモグロビン、緑色植物のクロロフィル、ビタミンB-12、ポリエチレンの製造に使用される触媒などは、すべて配位化合物を含んでいます。金属、特に遷移金属のイオンは錯体を形成する可能性が高いです。これらの化合物の多くは鮮やかな色を有しています(図19.12)。この章の残りの部分では、私たちはこれらの注目すべき化合物の構造と結合について考えていきます。

図19.12 | 部分的に満たされたd副殻を含む金属イオンは、通常は有色の錯イオンを形成し、空のd副殻(d⁰)または満たされたd副殻(d¹⁰)を持つイオンは、通常は無色の錯体を形成します。この図は、左側から右側へと、[M(H₂O)₆]ⁿ⁺イオン(M = Sc³⁺(d⁰)、Cr³⁺(d³)、Co²⁺(d⁷)、Ni²⁺(d⁸)、Cu²⁺(d⁹)、Zn²⁺(d¹⁰))を含む溶液を示しています。(credit: Sahar Atwa)
ほとんどの主族元素化合物では、孤立した原子の価電子が結合してオクテット則を満たす化学結合を形成していることを思い出してください。たとえば、炭素の4つの価電子が4つの水素原子からの電子と重なってCH₄を形成します。1つの価電子がナトリウムから離れ、塩素の7つの価電子に加わることで、イオン式の単位NaClが形成されます(図19.13)。遷移金属は通常、このような方法では結合しません。遷移金属は主に配位共有結合を形成しますが、これはルイス酸-塩基相互作用の一形態で、結合内の電子の両方が供与体(ルイス塩基)から受容体(ルイス酸)へと与えられます。配位錯体におけるルイス酸(しばしば中心金属イオン(または原子)と呼ばれます)は、しばしば遷移金属または内部遷移金属ですが、主族元素もまた配位化合物を形成することができます。配位子と呼ばれるルイス塩基の供与体は、原子、分子、またはイオンなど、多種多様な化学物質であり得ます。唯一の要件は、それらが1つかそれ以上の電子対(中心の金属に提供されることが可能なもの)を持っていることです。多くの場合、金属との配位結合を形成することができる孤立電子対を持つ供与体の原子が関与します。
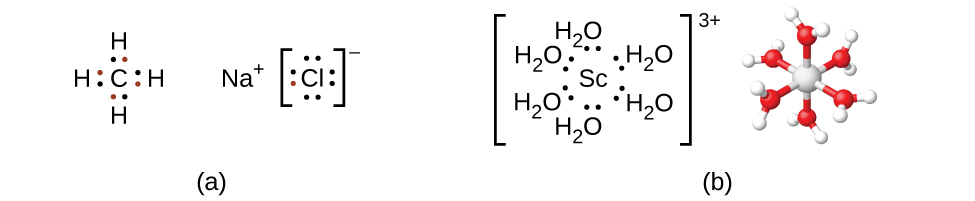
図19.13 | (a)共有結合は電子の共有を伴い、イオン結合は色のついた電子で示されるように、それぞれの結合原子に関連する電子の移動を伴います。(b)しかしながら、配位共有結合は、ルイス塩基からの電子が中心金属に供与されることを伴います。6つの水分子からの孤立電子対がスカンジウムイオンと結合を形成して、八面体の錯体を形成します。(供与された対のみが示されています。)
配位圏は、中心の金属イオンまたは原子とそれに付随した配位子で構成されています。化学式の角括弧は配位圏を囲んでおり、角括弧外の種は配位圏の一部ではありません。中央の金属イオンまたは原子の配位数とは、それに結合した供与体原子の数のことです。[Ag(NH₃)₂]⁺の中の銀イオンの配位数は2です(図19.14)。[CuCl₄]²⁻の中の銅(II)イオンの配位数は4であり、[Co(H₂O)₆]²⁺の中のコバルト(II)イオンの配位数は6です。これらの配位子はいずれも単座(monodentate:「1つの歯」を意味するギリシャ語に由来)です。単座とは、配位子がただ1つの原子を介して中心金属とつながっていることを意味します。この場合、配位子の数と配位数は等しくなります。
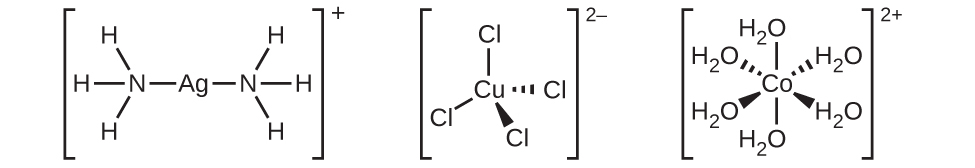
図19.14 | (a)[Ag(NH₃)₂]⁺、(b)[CuCl₄]²⁻、(c)[Co(H₂O)₆]²⁺は、それぞれ配位数が2、4、6です。これらの錯体の幾何構造は、主族元素についてのVSEPR理論で見てきたものと同じ、直線形、四面体形、八面体形です。
他の多くの配位子は、より複雑な態様で金属に配位しています。二座配位子とは、2つの原子が中心金属に配位する配位子のことです。たとえば、エチレンジアミン(H₂NCH₂CH₂NH₂、enと表記されます)は、2つの窒素原子を含み、それぞれが1つの孤立電子対を持ち、ルイス塩基として機能します(図19.15)。この原子はどちらも単一の中心金属に配位することができます。錯体[Co(en)₃]³⁺では、3つの二座性en配位子があり、コバルト(III)イオンの配位数は6です。最も一般的な配位数は2、4、6ですが、1から15までのすべての配位数の例が知られています。
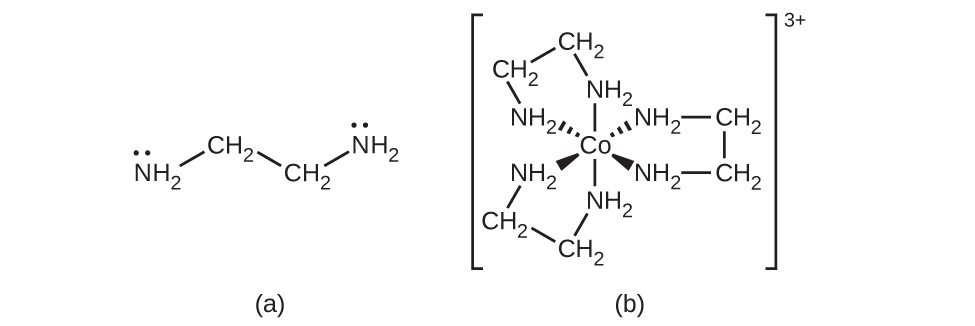
図19.15 | (a)エチレンジアミン(en)配位子は、中心金属に配位可能な孤立電子対を持つ2つの原子を含んでいます。(b)コバルト(III)錯体[Co(en)₃]³⁺にはこれらの配位子が3つ含まれており、それぞれがコバルトイオンに対して2つの結合を形成しています。
複数の供与体原子によって中心の金属イオンに結合するすべての配位子は、多座配位子(すなわち「多くの歯」)です。なぜなら、それは複数の結合で中心金属に食い込むことができるからです。「爪」を意味するギリシャ語に由来するキレートという用語も、この種の相互作用を記述するために使用されています。多くの多座配位子はキレート配位子であり、これらの配位子の1つかそれ以上と中心金属からなる複合体がキレートです。キレート配位子はキレート剤としても知られています。キレート配位子は、カニの爪がビー玉をはさむかのようにして、金属イオンを保持します。図19.15にキレートの一例を示しています。ヘモグロビンの中のヘム錯体は、もう1つの重要な例です(図19.16)。これは、鉄に配位する4つの供与体原子を持つ多座配位子を含んでいます。
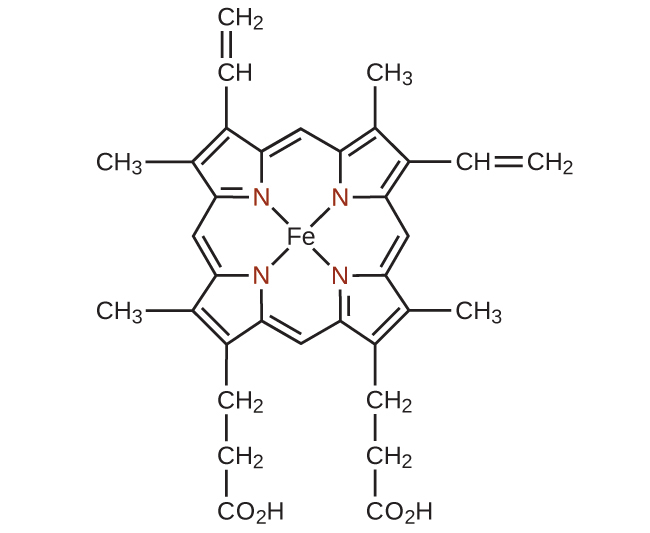
図19.16 | 単一の配位子であるヘムは、ヘモグロビンの中の鉄に配位してキレートを形成するような4つの窒素原子を含みます。
多座配位子は、配位子の中の供与体原子の数を示す接頭辞で識別されることがあります。私たちがこれまで見てきたように、NH₃、Cl⁻、H₂Oのような供与体原子を1つ持つ配位子は、単座配位子です。2つの供与体基を持つ配位子は二座配位子です。エチレンジアミンH₂NCH₂CH₂NH₂、および酸のグリシンのアニオンNH₂CH₂CO₂⁻(図19.17)などが二座配位子の例です。三座配位子、四座配位子、五座配位子、六座配位子はそれぞれ 3個、4個、5個、6個の供与体原子を持っています。ヘムの配位子(図19.16)は四座配位子です。
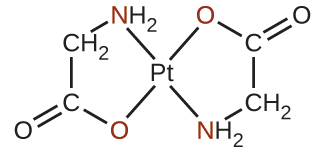
図19.17 | 示されているアニオン性の配位子のそれぞれは、窒素原子と酸素原子の両方が白金(II)に配位しており、この金属に二座の態様で結合しています。
錯体の命名
錯体の命名法は、スイスの化学者でありノーベル賞受賞者でもあるアルフレート・ヴェルナーによって提案された体系によってパターン化されています。100年以上前の彼の卓越した研究は、これらの化合物をより明確に理解するための基礎を築きました。錯体の命名には以下の5つの規則が用いられています:
配位化合物がイオン性の場合は、通常の命名法に従ってカチオンを先に、アニオンを後に命名します。
配位子の名前を最初に付け、次に中心金属の名前を付けます。配位子の名前はアルファベット順に記載します。負の配位子(アニオン)は、その基の名前の語幹に-オ(-o)を加えることによって形成される名前を持ちます。たとえば、表19.1を参照してください。ほとんどの中性配位子については、分子の名前が使われます。4つの一般的な例外はアクア(H₂O)、アンミン(NH₃)、カルボニル(CO)、ニトロシル(NO)です。たとえば、[Pt(NH₃)₂Cl₄]は、ジアンミンテトラクロロ白金(IV)と名付けられます。
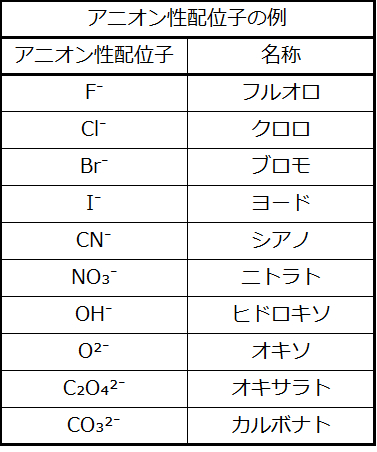
表19.1
- ある種類の配位子が複数存在する場合、その数は接頭辞のジ-(di-:2つの場合)、トリ-(tri-:3つの場合)、テトラ-(tetra-:4つの場合)、ペンタ-(penta-:5つの場合)、ヘキサ-(hexa-:6つの場合)で示されます。配位子の名前に既にジ-、トリ-、テトラ-が含まれている場合や、配位子の名前が母音で始まる場合には、接頭辞のビス-(bis-:2つの場合)、トリス-(tris-:3つの場合)、およびテトラキス-(tetrakis-:4つの場合)が使用されることがあります。たとえば、イオンのビス(ビピリジル)オスミウム(II)は、Osに結合した2つの配位子があることを示すためにビス-を使用し、それぞれのビピリジル配位子は2つのピリジン基(C₅H₄N)を含みます。
錯体がカチオンまたは中性分子の場合、中心金属原子の名前は元素の名前と全く同じ綴りで、その後に括弧内に入れられたローマ数字がその酸化状態を示すために続きます(表19.2および表19.3)。錯体がアニオンの場合、金属の名前の語幹に-エイト(-ate)という接尾辞が付加され、その後にその酸化状態を示すローマ数字が続きます(表19.4)。英語名がうまく当てはまらない場合、金属のラテン語名が使われることがあります。たとえば、アイロネートの代わりにフェレイト(鉄酸)が、リーデイトの代わりにプラムベイト(鉛酸)が、ティネイトの代わりにスタネイト(スズ酸)が使用されます。金属の酸化状態は、それぞれの配位子の電荷と配位化合物の全体の電荷に基づいて決定されます。たとえば、[Cr(H₂O)₄Cl₂]Brの場合、配位圏(角括弧内)は臭化物イオンとのバランスをとるために1+の電荷を持ちます。水配位子は中性であり、塩化物配位子はそれぞれ1-の電荷を持つアニオン性です。金属の酸化状態を決めるためには、全体の電荷を配位子と金属の和に等しく設定します:+1 = -2 + xなので、酸化状態(x)は3+となります。
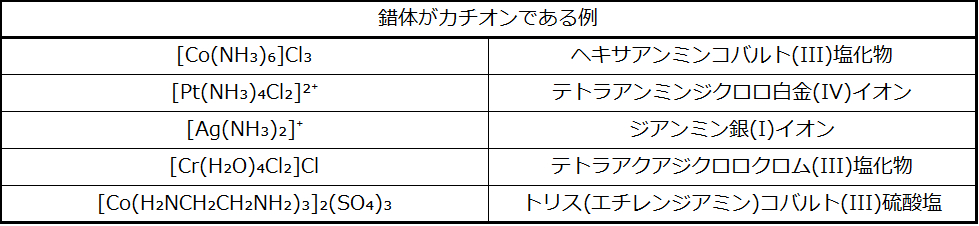
表19.2

表19.3

表19.4
学習へのリンク
あなたは、自分が配位錯体の命名法を理解していると思いますか?シドニー大学のサイトにあるオンラインクイズ(http://openstaxcollege.org/l/16namingcomps)で、より多くの例を見たり、自分自身をテストしたりすることができます。
例題19.4 配位数と酸化状態
以下の錯体の名称を決定し、中心金属原子の配位数を示してください。
(a)Na₂[PtCl₆]
(b)K₃[Fe(C₂O₄)₃]
(c)[Co(NH₃)₅Cl]Cl₂
解法
(a)Na⁺イオンが2つあるので、配位圏は負の2つの電荷を持ちます:[PtCl₆]²⁻。アニオン性塩化物配位子が6個あるので、-2 = -6 + xとなり、白金の酸化状態は4+となります。この錯体の名称はヘキサクロロ白金(IV)酸ナトリウムであり、配位数は6です。
(b)配位圏は(カリウムに基づいて)3−の電荷を持ち、シュウ酸配位子はそれぞれ2−の電荷を持つので、金属の酸化状態は−3 = −6 + xで与えられます。これは鉄(III)錯体です。名称はトリスオキサラト(III)酸カリウムです(配位子名が母音で始まるので、トリの代わりにトリスが使われていることに注意してください)。オキサラトは二座配位子なので、この錯体の配位数は6です。
(c)この例では、配位圏は2+のカチオン性の電荷を持ちます。NH₃配位子は中性ですが、クロロ配位子は1-の電荷を持っています。酸化状態は+2 = -1 + xで求められ、3+であるので、この錯体はペンタアンミンクロロコバルト(III)塩化物であり、配位数は6です。
学習内容の確認
ジシアノ銀(I)酸カリウムという錯体は、防腐性化合物の製造に用いられます。化学式と配位数を示してください。
解答:K[Ag(CN)₂]、配位数は2
錯体の構造
配位化合物における錯体の最も一般的な構造は、八面体形、四面体形、平面四角形です(図19.18参照)。遷移金属錯体の場合、配位数によって中心金属イオンの周りの幾何構造が決まります。表19.5は、配位数と分子の幾何構造を比較したものです:
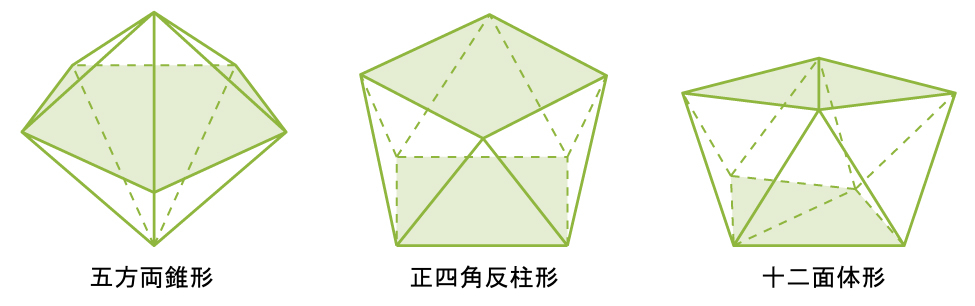
図19.18 | これらは、配位数が7および8のいくつかの錯体の幾何構造です。
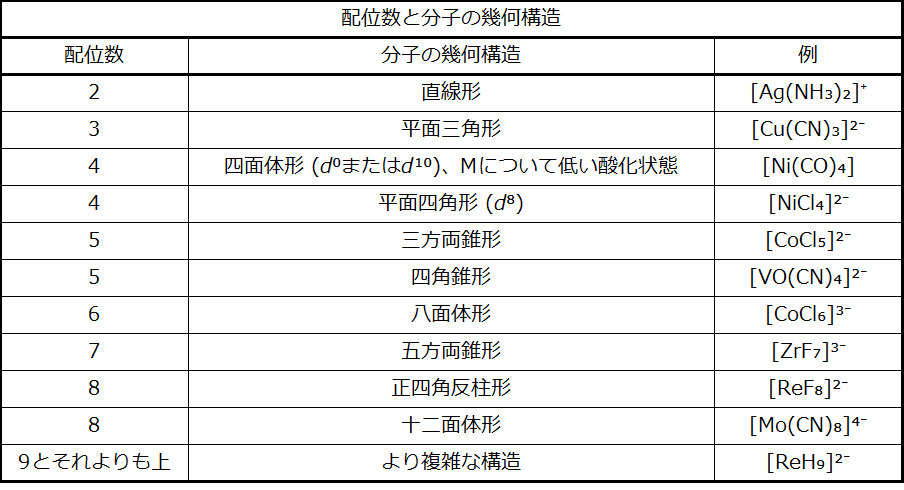
表19.5
結合電子と非結合電子の両方が分子の形状を決定する主族原子とは異なり、非結合d電子は配位子の配置を変更しません。八面体形の錯体は配位数が6で、6つの供与体原子が中心の金属イオンの周りで八面体の角に配置されています。例が図19.19に示されています。[Co(H₂O)₆]Cl₂の塩化物アニオンと[Cr(en)₃](NO₃)₃の硝酸アニオン、およびK₂[PtCl₆]のカリウムカチオンは角括弧の外側にあり、金属イオンとは結合していません。
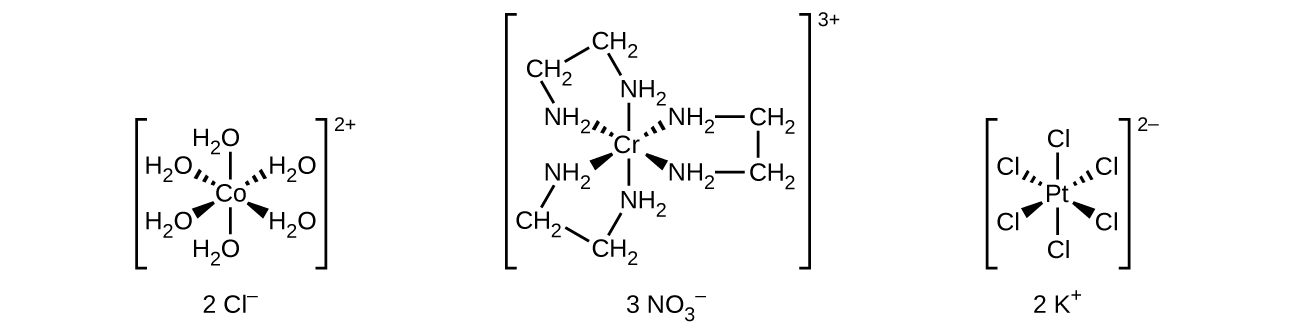
図19.19 | 多くの遷移金属錯体は八面体形の幾何構造をしており、6個の供与体原子は中心原子の周囲で隣接する配位子と90°の結合角を形成しています。配位圏内の配位子のみが中心金属の周りの幾何構造に影響を与えることに注意してください。
配位数が4の遷移金属では、四面体形または平面四角形という2つの異なる幾何構造が可能です。これらの幾何構造がVSEPR理論から予測できる主族元素とは異なり、どの錯体が四面体形となり、どの錯体が平面四角形となるかを予測するには、遷移金属軌道のより詳細な議論(結晶場理論の節で議論されています)が必要です。[Zn(CN)₄]²⁻(図19.20) のような四面体形の錯体では、配位子対のそれぞれが 109.5°の角度を形成しています。[Pt(NH₃)₂Cl₂]のような平面四角形の錯体では、それぞれの配位子は、90°の角度にある(シス位置と呼ばれます)他の2つの配位子と、180°の角度にある(トランス位置)1つの追加の配位子を持っています。
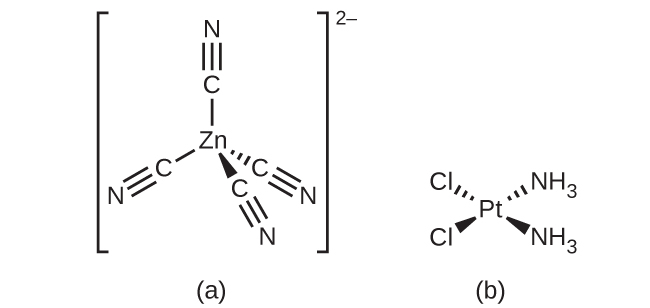
図19.20 | 配位数が4の遷移金属は、K₂[Zn(CN)₄]のような四面体形(a)や、[Pt(NH₃)₂Cl₂]のような平面四角形(b)となることができます。
錯体の異性
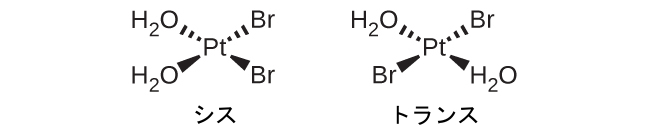
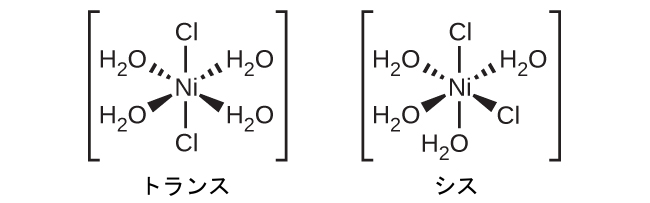
異性体とは、同じ化学式を持つ異なる化学種のことです。遷移金属錯体はしばしば幾何異性体として存在します。幾何異性体の中では、同じ原子が同じ種類の結合を介して接続されていますが、空間内での向きが異なります。ある注目する配位子に対してシス位置とトランス位置に2つの異なる配位子を持つ配位錯体は、異性体を形成します。たとえば、八面体形の[Co(H₂O)₄Cl₂]⁺イオンには2つの異性体があります。シス配置では、2つの塩化物配位子は互いに隣接しています(図19.21)。もう1つの異性体はトランス配置で、2つの塩化物配位子が直接向かい合っています。
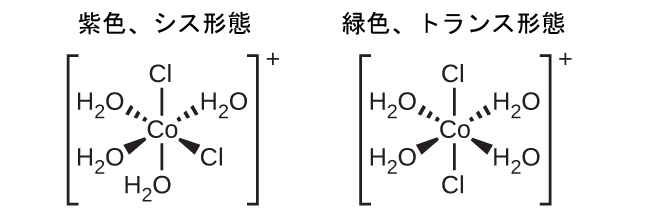
図19.21 | [Co(H₂O)₄Cl₂]⁺のシス異性体とトランス異性体は、同じ金属イオンに結合した同じ配位子を含んでいますが、空間的な配置のために、これら2つの化合物は非常に異なる性質を持っています。
ある物質の異なる幾何異性体は、異なる化学化合物となります。それらは同じ化学式を持っていても、異なる性質を示します。たとえば、[Co(NH₃)₄Cl₂]NO₃の2つの異性体は色が異なります。シス形態は紫色であり、トランス形態は緑色です。さらに、これらの異性体は双極子モーメント、溶解度、反応性が異なります。空間内の配置がどのようにして分子の性質に影響を与えるかの例として、2つの[Co(NH₃)₄Cl₂]NO₃の異性体の極性を考えてみましょう。分子やイオンの極性は、結合双極子(結合している原子の電気陰性度の違いによるもの)と空間内の配置によって決まるということを思い出してください。一方の異性体では、シス塩化物配位子によって分子の片側の電子密度がもう片側の電子密度よりも高くなり、極性を持つようになります。トランス異性体では、それぞれの配位子が同一の配位子の真向かいにあるため、結合双極子が相殺され、分子は非極性となります。
例題19.5 幾何異性体
図19.20には、[Pt(NH₃)₂Cl₂]のどちらの幾何異性体が示されているかを特定してください。もう一方の幾何異性体を描き、その完全な名前を述べてください。
解法
図19.20では、2つの塩素配位子がシス位置を占めています。他の形態は図19.22に示されています。特定の異性体に名前を付けるときは、名前の前に記述子を記載します。したがって、この錯体はトランス-ジアンミンジクロロ白金(II)です。
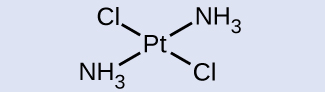
図19.22 | [Pt(NH₃)₂Cl₂]のトランス異性体は、隣接する配位子の真向かいにそれぞれの配位子があります。
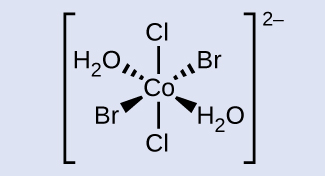
学習内容の確認
トランス-ジアクア-トランス-ジブロモ-トランス-ジクロロコバルト(II)のイオンを描いてください。
解答:
もう1つの重要なタイプの異性体は、光学異性体、またはエナンチオマーです。そこでは、2つの物体は互いに正確な鏡像ですが、すべての部分が一致するように並べることができません。これは、光学異性体が重ね合わせ不可能な鏡像であることを意味します。これについての古典的な例は両手であり、右手と左手は互いに相手方の鏡像ですが、重ね合わせることはできません。光学異性体は、有機化学や生化学において非常に重要な意味を持ちます。なぜなら、生物系はしばしば1つの特定の光学異性体を組み込んでおり、もう一方を組み込んでいないからです。幾何異性体とは異なり、光学異性体のペアは同じ性質(沸点、極性、溶解度など)を持っています。光学異性体は、偏光に影響を与える方法と、他の光学異性体との反応の仕方が異なるだけです。配位錯体の場合、[M(en)₃]ⁿ⁺[ここでMⁿ⁺は鉄(III)やコバルト(II)などの中心金属イオン]のような多くの配位化合物は、図19.23に示されるように、エナンチオマーを形成します。これら2つの異性体は、他の光学異性体とは異なる反応をします。たとえば、DNAのらせんは光学異性体であり、自然界に存在する形態(右利きのDNA)は[M(en)₃]ⁿ⁺の1つの異性体にのみ結合し、他の異性体には結合しません。
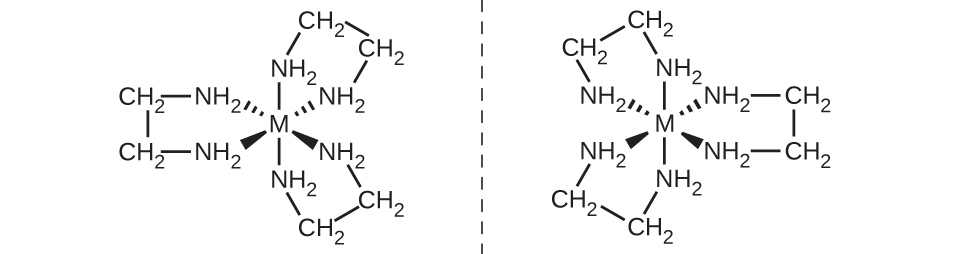
図19.23 | 錯体[M(en)₃]ⁿ⁺(Mⁿ⁺ = 金属イオン、en = エチレンジアミン)は、重ね合わせ不可能な鏡像を持っています。
[Co(en)₂Cl₂]⁺イオンは幾何異性(シス/トランス)を示し、そのシス異性体は一対の光学異性体として存在します(図19.24)。
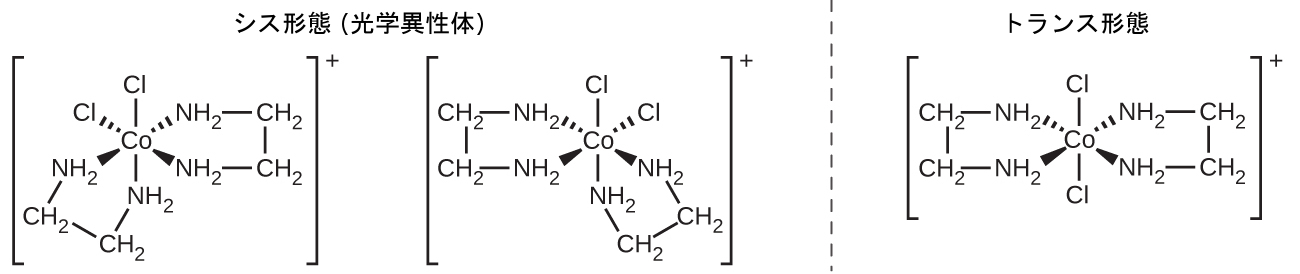
図19.24 | [Co(en)₂Cl₂]⁺には3つの異性体の形態が存在します。塩素が180°の角度で配置されたときに形成されるトランス異性体は、シス異性体とは非常に異なる性質を持っています。シス異性体の鏡像は一対の光学異性体を形成し、他のエナンチオマーと反応する場合を除き、それらは同一の振る舞いを示します。
結合異性体は、配位化合物が、2つの異なる原子を介して中心遷移金属に結合することができるような配位子を含む場合に生じます。たとえば、CN配位子は、炭素原子(シアノ)を介して、または窒素原子(イソシアノ)を介して結合することができます。同様に、SCN-は、硫黄原子を介して、または窒素原子を介して結合することができ、2つの異なる化合物([Co(NH₃)₅SCN]²⁺または[Co(NH₃)₅NCS]²⁺)を得ます。
イオン化異性体(または配位異性体)は、内側の配位圏内の1つのアニオン性配位子が外側の配位圏からの対イオンで置き換えられたときに生じます。2つのイオン化異性体の簡単な例としては、[CoCl₆][Br]と[CoCl₅Br][Cl]があります。
自然界と技術分野における配位錯体
植物の緑色の色素であるクロロフィルは、マグネシウムを含む錯体です(図19.25)。これは、配位錯体の中の主族元素の一例です。植物が緑色に見えるのは、クロロフィルが赤色や紫色の光を吸収し、その結果として反射光が緑色に見えるからです。光を吸収して得られたエネルギーは、光合成に利用されます。
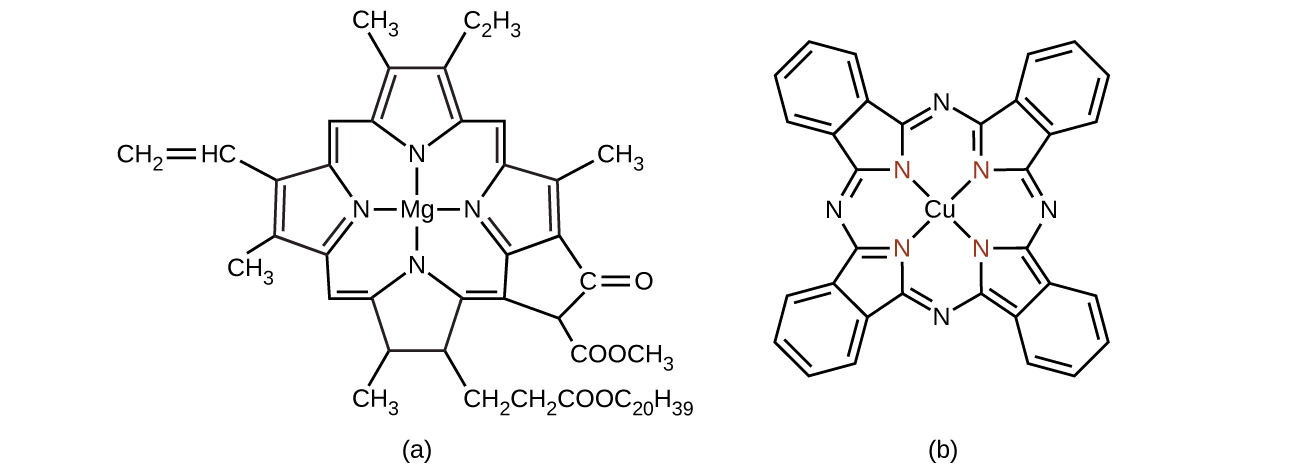
図19.25 | (a)クロロフィルにはいくつかの異なる形態がありますが、そのすべては中心マグネシウムの周りに同じ基本的な構造を有しています。(b)銅フタロシアニンブルーは、平面四角形の銅の錯体で、いくつかの青色染料の中に存在します。
日常生活の中の化学
遷移金属触媒
遷移金属の最も重要な用途の1つは、工業用触媒です。あなたが反応速度論の章から思い出せるように、触媒は、活性化エネルギーを下げることによって反応速度を速め、触媒サイクルの中で再生されます。すべての製造品の90%以上は、1つかそれ以上の触媒の助けを借りて作られています。遷移金属触媒は、配位子に結合し、酸化状態を変化させる能力があるため、触媒の用途に適しています。酸化バナジウムは、世界中で年間2億3000万トンの硫酸を生産するために使用されており、その硫酸は肥料から食品用の缶詰まで、あらゆるものの製造に使用されています。プラスチックは、洗剤、肥料、塗料などとともに、遷移金属触媒の助けを借りて製造されています(図19.26を参照)。非常に複雑な医薬品は、多数の可能性の中から特定の結合に反応する選択性の高い触媒を用いて製造されています。触媒によって、プロセスをより経済的に、より環境に優しいものにすることができます。新しい触媒の開発と既存のシステムの理解を深めることが、現在の研究の重要な分野です。

図19.26 | (a)洗剤、(b)塗料、(c)肥料はすべて遷移金属触媒を用いて作られています。(credit a: modification of work by “Mr. Brian”/Flickr; credit b: modification of work by Ewen Roberts; credit c: modification of work by “osseous”/Flickr)
化学者の肖像
ディアナ・ダレッサンドロ
ディアナ・ダレッサンドロ博士は、独特な電子的、光学的、磁気的性質を示す新しい金属含有材料を開発しています。彼女の研究は、基礎的な無機化学・物理化学と材料工学の分野を組み合わせたものです。彼女は、遷移金属に依拠するさまざまなプロジェクトに取り組んでいます。たとえば、彼女が開発している化合物の1つは、発電所から排出される二酸化炭素廃棄物を回収し、触媒によって有用な製品に変換するものです(図19.27参照)。
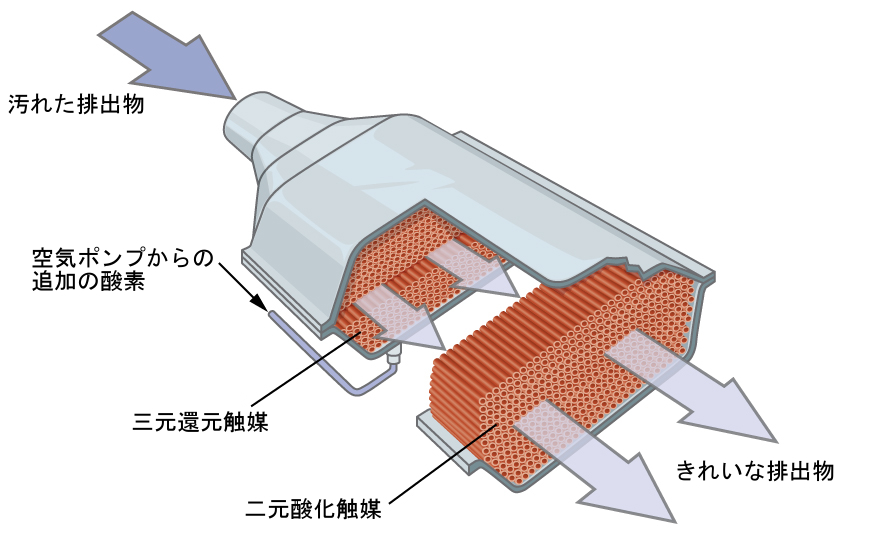
図19.27 | 触媒コンバーターは、発電所から排出される二酸化炭素を有用な製品に変えるもので、ここに示されるようなものは自動車にも見られます。
もう1つのプロジェクトでは、「光活性」を持つ多孔質スポンジ状の材料を開発しています。光を吸収することでスポンジの細孔の大きさが変化し、気体の拡散を制御することができます。これは、水素燃料電池を搭載した自動車の動力源から、より優れた電子部品の製造まで、多くの有用な応用の可能性を秘めています。複雑なものではありませんが、自然に色の暗くなるサングラスは光活性物質の一例です。
この研究についてより詳しく学ぶためには、このビデオ(http://openstaxcollege.org/l/16DeannaD)を見て、ダレッサンドロ博士(図19.28)が研究化学者であるとはどのようなものであるかについて語るのを聞いてください。

図19.28 | ディアナ・ダレッサンドロ博士は機能性材料の研究者です。彼女の仕事は、無機化学・物理化学の分野と工学の分野を組み合わせたもので、遷移金属を使って、自動車に動力を供給したり、エネルギーを変換したりするための新しいシステムを作ることに取り組んでいます。(credit: image courtesy of Deanna D’Alessandro)
他の多くの配位錯体もまた、鮮やかな色をしています。平面四角形の銅(II)錯体フタロシアニンブルー(図19.25より)は、顔料や染料として使われる多くの錯体のうちの1つです。この錯体は、青色のインク、ブルージーンズ、特定の青色の塗料に使用されています。
ヘモグロビンの中の鉄含有錯体であるヘム(図19.29)の構造は、クロロフィルの構造と非常によく似ています。ヘモグロビンでは、ヘム配位子にタンパク質が付着することによって、赤色のヘム錯体が大きなタンパク質分子(グロビン)に結合しています。酸素分子は、ヘモグロビンの中心の鉄に結合されることで、ヘモグロビンにより血液中を運ばれていきます。ヘモグロビンが酸素を失うと、青みがかった赤色に変色します。ヘモグロビンが酸素を運ぶのは、鉄がFe²⁺の場合のみで、鉄がFe³⁺に酸化されると酸素が運ばれなくなります。
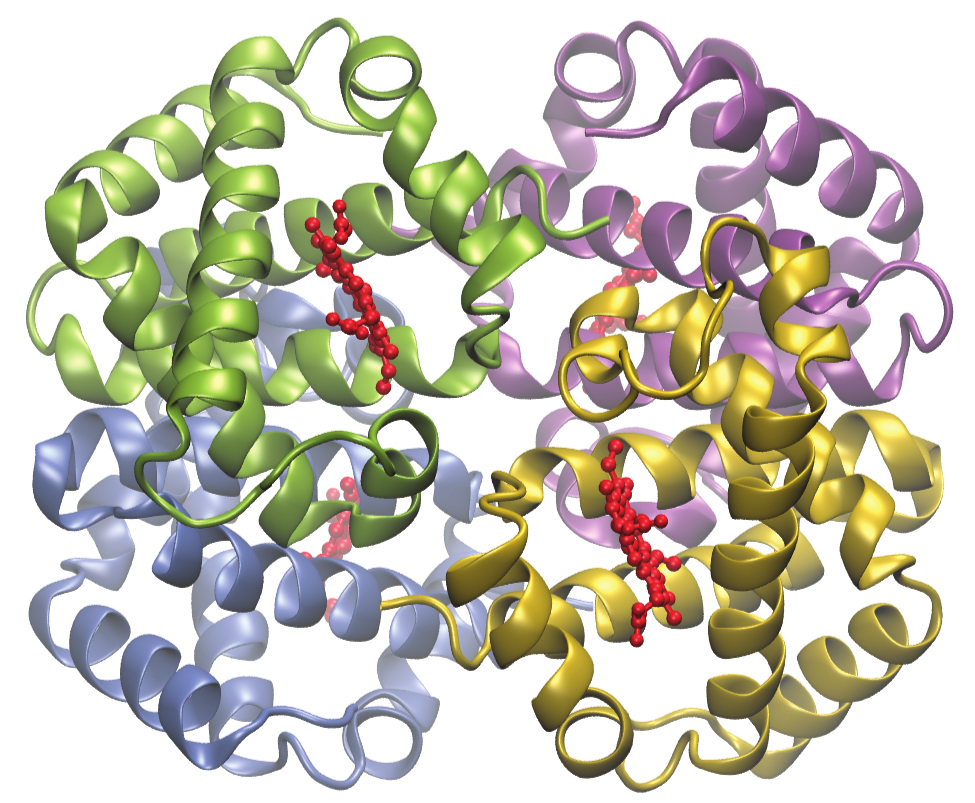
図19.29 | ヘモグロビンには4つのタンパク質サブユニットがあり、それぞれのサブユニットは中心の鉄がヘム配位子(赤色で表示)に結合していて、それがグロビンタンパク質へと配位しています。それぞれのサブユニットは異なる色で示されています。
錯化剤は、水を硬水にするCa²⁺、Mg²⁺、Fe²⁺などのイオンと結びつくため、水の軟化によく使用されます。また、多くの金属イオンは、食品の色を変える反応を触媒するため、食品には好ましくありません。配位錯体は防腐剤として有用です。たとえば、(HO₂CCH₂)₂NCH₂CH₂N(CH₂CO₂H)₂という配位子EDTAは、6個の供与体原子を介して金属イオンに配位し、金属が反応するのを防ぎます(図19.30)。この配位子は、紙製品、繊維製品、洗剤などの中の金属イオンを隔離するためにも利用されており、医薬品としても利用されています。
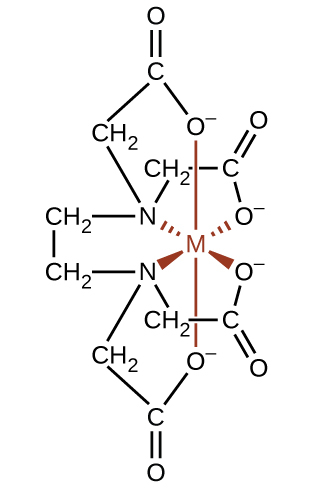
図19.30 | 配位子EDTAは、六座錯体を形成することにより、さまざまな金属イオンと強固に結合します。
金属イオンに結びつく錯化剤は医薬品としても利用されています。ジメルカプロールHSCH₂CH(SH)CH₂OH(British Anti-Lewisite:BAL)は、第一次世界大戦中にヒ素を主成分とする戦争用ガスであるルイサイトの解毒剤として開発された薬剤です。現在では、BALはヒ素、水銀、タリウム、クロムなどの重金属による中毒の治療に使用されています。この薬は配位子であり、金属の水溶性キレートを作ることによって機能します。腎臓はこの金属キレートを除去します(図19.31)。もう1つの多座配位子であるエンテロバクチンは、特定の細菌から単離されたものであり、鉄の錯体を形成し、それによって、頻繁に輸血を必要とするクーリー貧血(サラセミア)のような血液疾患に苦しむ患者に見られる重度の鉄の蓄積を制御するために使用されます。輸血された血液が分解されると、鉄分を除去する通常の代謝プロセスに大きな負荷がかかり、過剰な鉄分が致命的なレベルまで蓄積される可能性があります。エンテロバクチンは過剰な鉄と結びついて水溶性の錯体を形成し、体はこの錯体を安全に除去することができます。
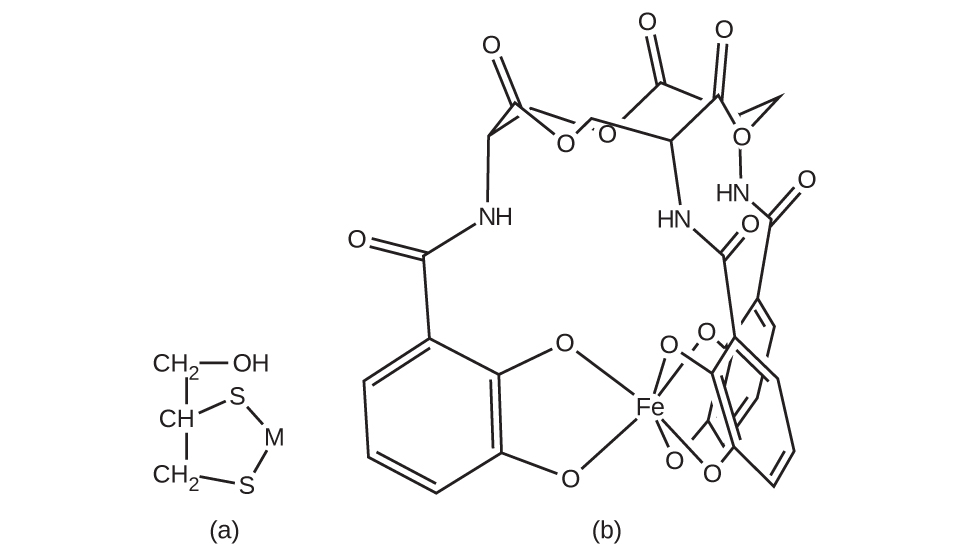
図19.31 | 配位錯体は医薬品として使用されています。(a)ジメルカプロールは、金属(M)を配位させることによって重金属中毒の治療に用いられ、(b)エンテロバクチンは血中の過剰な鉄を除去することができます。
例題19.6 キレート療法
BALやエンテロバクチンなどの配位子は重金属中毒の治療に重要な役割を果たしています。しかしながら、キレート療法は体内の正常なイオン濃度を乱し、重篤な副作用につながる可能性があるため、研究者は新しいキレート治療薬を探しています。これまでに開発された薬剤の1つが、図19.32に示されているジメルカプトコハク酸(DMSA)です。この分子内のどの原子が供与体原子として作用するかを特定してください。
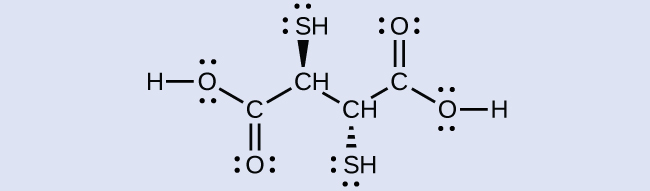
図19.32 | ジメルカプトコハク酸は、重金属中毒の治療に用いられています。
解法
酸素原子と硫黄原子はすべて、中心金属に配位するために使用できる孤立電子対を持っているので、6つの可能な供与体原子があります。幾何構造的には、これらの原子のうち2つだけが一度に金属に配位することができます。最も一般的な結合様式は、1つの硫黄原子と1つの酸素原子の配位であり、金属と五員環を形成します。
学習内容の確認
代替医療の実践者の中には、重金属とは明らかに関係のないがんや自閉症などの疾患にキレート療法を推奨する人もいますが、多くの科学的組織はその実践を推奨していません。[1]キレート療法によって混乱させられる可能性のある生物学的に重要な金属を少なくとも2つ挙げてください。
解答:Ca、Fe、Zn、およびCu
配位子は電気めっき産業でも使用されています。金属イオンが還元されて薄い金属コーティングを生成するときには、金属が凝集してクラスターやナノ粒子を形成することがあります。金属配位錯体が使用されている場合、配位子は金属原子を互いに分離した状態に保ちます。多くの金属は、金属を錯イオンとして含む槽からめっきすると、より滑らかで、より均一で、見栄えがよく、より付着性の高い表面としてめっきされることがわかっています。そのため、[Ag(CN)₂]⁻や[Au(CN)₂]⁻などの錯体が、電気めっき産業で広く使用されています。
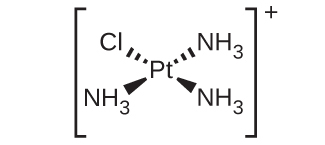
1965年、ミシガン州立大学の科学者たちは、特定の微生物の細胞分裂を阻害する白金錯体が存在することを発見しました。その後の研究により、この錯体はシス-ジアミンジクロロ白金(II)[Pt(NH₃)₂(Cl)₂]であり、トランス異性体は効果がないことが明らかになりました。細胞分裂を阻害することは、この平面四角形の化合物が抗がん剤になり得ることを示唆しました。1978年、米国食品医薬品局は、シスプラチンとして知られるこの化合物を、特定の形態のがんの治療に使用することを承認しました。それ以来、多くの類似の白金化合物ががんの治療のために開発されています。すべての場合において、これらはシス異性体であり、トランス異性体ではありません。ジアンミン(NH₃)₂部分は維持され、ジクロロ[(Cl)₂]部分は他の基に代わっています。新薬としては、カルボプラチン、オキサリプラチン、サトラプラチンなどがあります。
19.3 配位化合物の分光学的・磁気的性質
この節が終わるまでに、あなたは次のことができるようになります:
•結晶場理論(CFT)の基本的な前提について概説する
•さまざまなd軌道分裂パターンに関連した分子幾何構造を特定する
•選択された遷移金属原子またはイオンの分裂d軌道の電子配置を予測する
•CFTの概念の観点からスペクトル特性と磁気的性質を説明する
配位化合物の振る舞いは、主族元素の化学的性質のために用いられるのと同じ理論では十分に説明することができません。また、配位錯体において観測される幾何構造は、原子価結合理論によって予測されるような中心金属上の混成軌道と配位子軌道が重なり合っているものとは一致しません。観測される色は、d軌道がすべて等しいエネルギーへと縮退している(3つのp軌道のように)のではなく、d軌道がしばしば異なるエネルギー準位で発生していることを示しています。遷移金属錯体の安定性、構造、色、磁気特性を説明するために、別の結合モデルが開発されています。原子価結合理論が主族化学における結合の多くの側面を説明するのと同じように、結晶場理論は遷移金属錯体の振る舞いを理解し、予測するのに有用です。
結晶場理論
遷移金属錯体の観測された振る舞い(どのようにして色が生じるかなど)を説明するために、配位子の電子と中心金属原子の非混成d軌道の電子との間の静電相互作用を含むモデルが開発されました。この静電モデルが結晶場理論(CFT)です。これにより、私たちは遷移金属の配位化合物の色や磁気的な振る舞い、一部の構造を理解、解釈、予測することができます。
CFTは、金属-配位子結合ではなく、配位錯体の中心金属イオンの非結合電子に着目しています。原子価結合理論と同様に、CFTは錯体の振る舞いの一部を説明しているに過ぎません。しかしながら、CFTは原子価結合理論では説明できない部分を説明してくれます。その純粋な形では、CFTは配位子と金属イオンの間のいかなる共有結合をも無視します。配位子と金属はどちらも無限に小さな点電荷として扱われます。
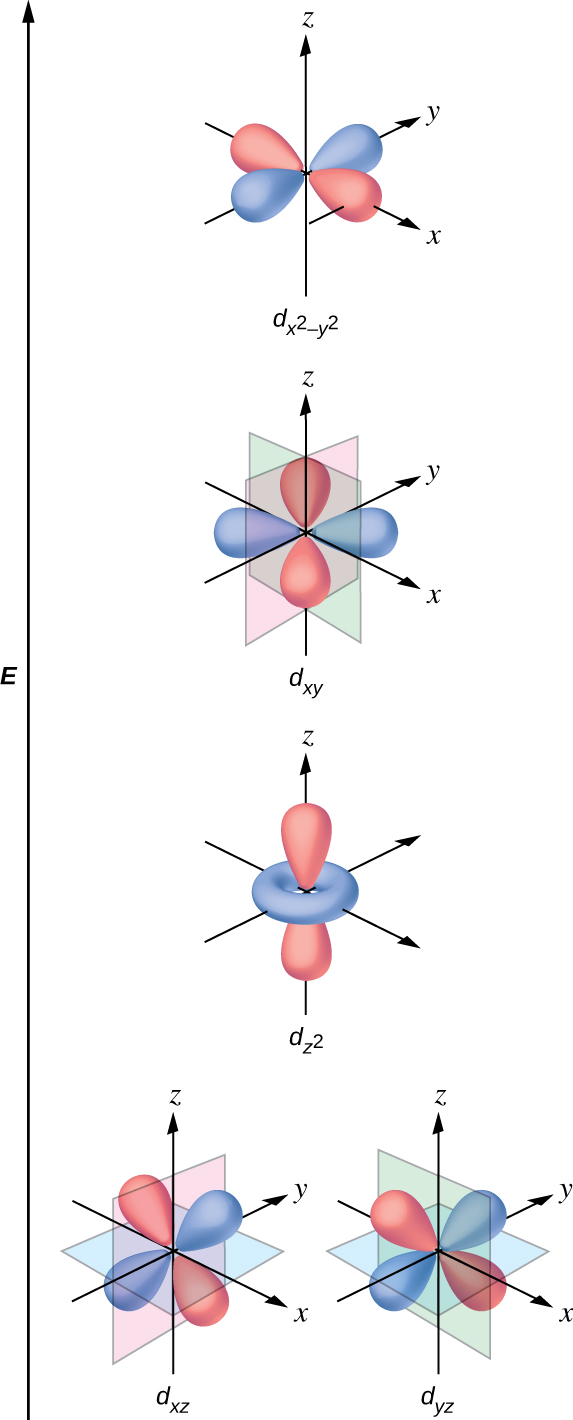
すべての電子は負であるため、配位子から供与された電子は中心金属の電子と反発するでしょう。ここで、八面体形の錯体の非混成d軌道の電子の振る舞いを考えてみましょう。図19.33に示されるように、5つのd軌道は葉状の領域からなり、空間的に配置されています。八面体形の錯体では、6つの配位子が軸に沿って配位しています。
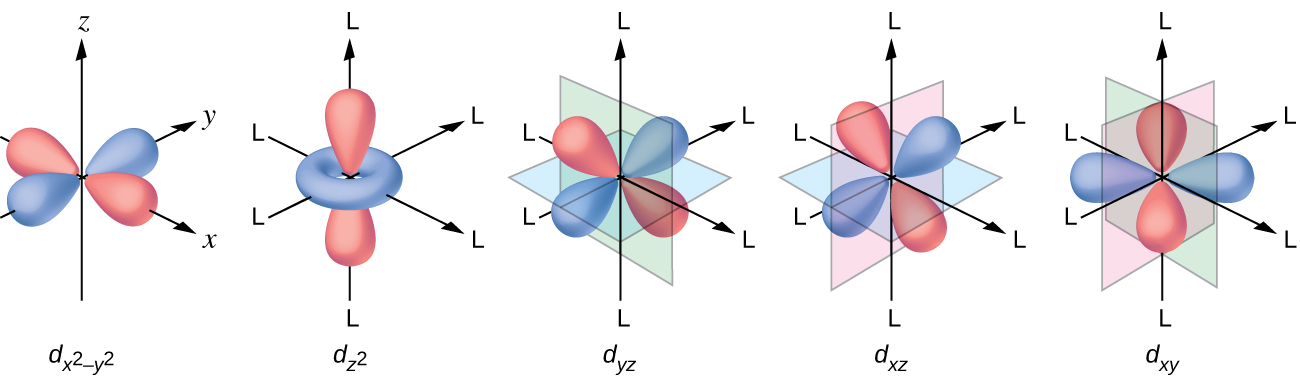
図19.33 | ここには5つのd軌道の方向性が示されています。陰影のついた部分は軌道の位相を示しています。配位子(L)は軸に沿って配位しています。わかりやすくするために、dx²-y²軌道では、軸のラベルを示すために配位子を省略しています。
気相中の非錯体金属イオンでは、電子はフントの規則に従って5つのd軌道に分配されています。なぜならすべての軌道が同じエネルギーを持っているからです。しかしながら、配位子が金属イオンに配位すると、d軌道のエネルギーは同じではなくなります。
八面体形の錯体では、5つのd軌道のうち2つのdz²とdx²-y²軌道の葉が配位子の方向を向いています(図19.33)。これら2つの軌道はeg軌道と呼ばれています(この記号は実際には軌道の対称性を指していますが、ここでは八面体形の錯体の中のこれら2つの軌道についての便利な名前として使用します)。他の3つの軌道、dxy、dxz、およびdyz軌道は、配位子の間を向いた葉を持っており、t2g軌道と呼ばれます(やはり、この記号は実際には軌道の対称性を指しています)。八面体の軸に沿って6つの配位子が金属イオンに近づくと、それらの点電荷が金属イオンのd軌道の電子を反発します。しかしながら、eg 軌道(dz²、dx²-y²軌道)の電子と配位子の間の反発力は、t2g 軌道(dzy、dxz、dyz軌道)の電子と配位子の間の反発力よりも大きくなります。これは、eg 軌道の葉が配位子に直接向いているのに対し、t2g 軌道の葉が配位子の間を向いているからです。したがって、八面体形の錯体中の金属イオンのeg軌道の電子は、t2g軌道の電子よりも高いポテンシャルエネルギーを持っています。このエネルギーの違いは、図19.34に示されるように表すことができます。
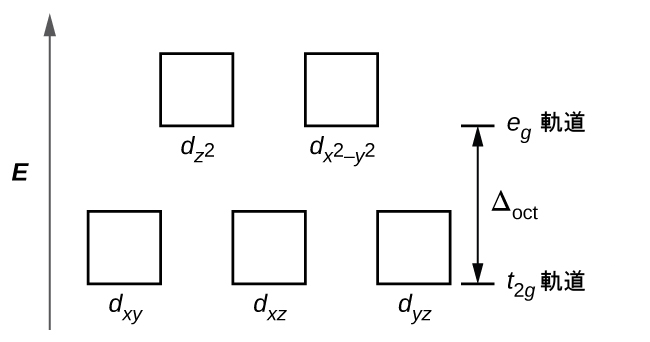
図19.34 | 八面体形の錯体では、eg 軌道は t2g 軌道に比べて不安定化しています(エネルギーが高いです)。なぜなら、配位子が直接向き合っているd軌道とより強く相互作用するからです。
eg軌道とt2g軌道の間のエネルギーの差は、結晶場分裂と呼ばれ、Δoctによって記号化されます(ここで、octは八面体形(octahedral)を表しています)。
Δoctの大きさは、中心の金属イオンの周りに配置された6つの配位子の性質、金属の電荷、金属が3d軌道、4d軌道、または5d軌道を使用しているかどうかなど、多くの要因に依存します。異なる配位子は、異なる結晶場分裂を生じさせます。配位子によって生じる結晶場分裂の増大は、分光化学系列で表されます。ここでは、その短いバージョンを示します:
\[ \rm \xrightarrow[配位子の電場の強さが増大する順に並んだ、分光化学系列のいくつかの配位子]{I^− < Br^− < Cl^− < F^− < H_2 O < {C_2 O_4}^{2−} < NH_3 < en < {NO_2}^− < CN^−} \]
この系列では、左側にある配位子は小さな結晶場分裂を起こす弱い電場の配位子であり、右側にある配位子は大きな分裂を起こす強い電場の配位子です。したがって、ヨウ化物配位子(I⁻)を持つ八面体形の錯体のΔoct値は、シアン化物配位子(CN⁻)を持つ同じ金属のΔoct値よりもはるかに小さいです。
d軌道の電子は構造(「満たしていく」)原理に従います。構造原理とは、軌道は全エネルギーが最小となるように満たされていく(主族化学と同じように)ということを述べるものです。2つの電子が同じ軌道を占有すると、似た電荷が互いに反発します。単一の軌道内で2つの電子が対を形成するのに必要なエネルギーは、対形成エネルギー(P)と呼ばれています。電子は、対を形成する前に、縮退の集合のそれぞれの軌道を常に単独で占有します。Pの大きさはΔoctに似ています。電子がd軌道を満たすとき、ΔoctとPの相対的な大きさによってどの軌道が占められるかが決定されます。
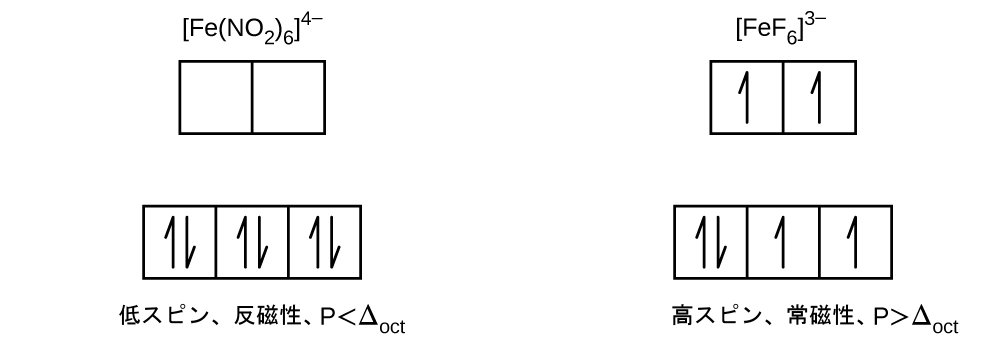
[Fe(CN)₆]⁴⁻では、6つのシアン化物配位子の強い電場により、大きなΔoctが生成されます。これらの条件下では、電子が対形成するために必要なエネルギーは、電子がeg軌道に励起されるために必要なエネルギーよりも少ないです(Δoct > P)。Fe²⁺イオンの6つの3d電子は3つのt2g軌道で対になります(図19.35)。結晶場分裂が大きいために電子が対になっている錯体は、低スピン錯体と呼ばれています。なぜなら、対になっていない電子(スピン)の数が最小化されているためです。
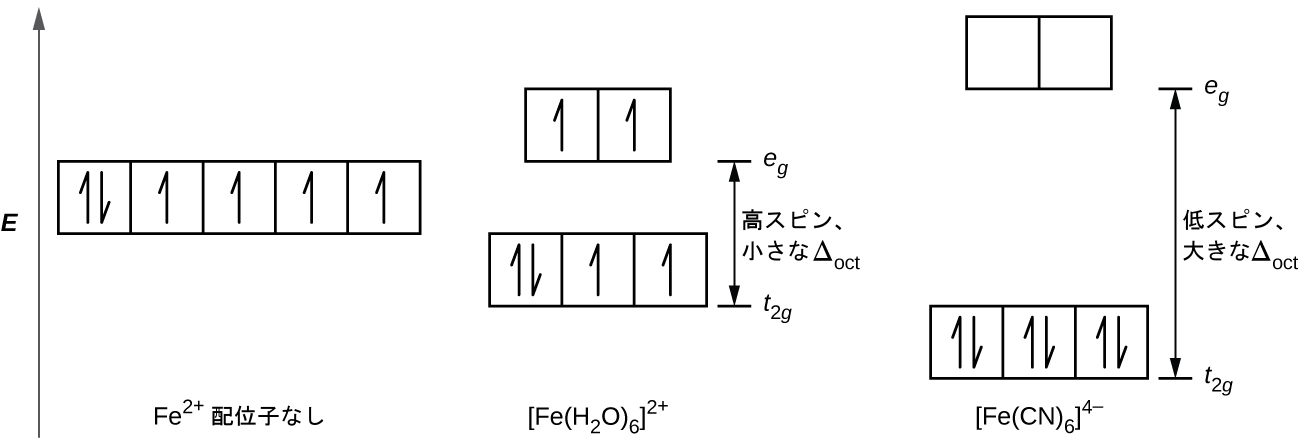
図19.35 | 鉄(II)錯体は5d軌道に6個の電子を持っています。結晶場がない場合、軌道は縮退しています。[Fe(CN)₆]⁴⁻のような強電場配位子を持つ配位錯体では、ΔoctはPよりも大きく、電子は低エネルギーの t2g 軌道で対となってから eg 軌道を占有します。H₂Oのような弱電場配位子では、配位子の電場分裂は対形成エネルギーよりも小さく、ΔoctはPよりも小さいため、電子は対形成を行う前にすべてのd軌道を単独で占有します。
一方、[Fe(H₂O)₆]²⁺では、水分子の弱い電場により、小さな結晶場分裂(Δoct < P)しか生じません。電子が一緒に対形成するよりも、eg軌道を占有するほうが必要なエネルギーがより少ないため、対形成が発生する前には、5つの3d軌道のそれぞれに1つの電子があることになります。[Fe(H₂O)₆]²⁺の中心の鉄(II)の6個のd電子については、1対の電子と4個の不対電子が存在することになります(図19.35)。[Fe(H₂O)₆]²⁺イオンのように、結晶場分裂が電子を対形成させるほど大きくないために電子が不対となっている錯体は、高スピン錯体と呼ばれています。なぜなら、不対電子(スピン)の数が最大化されているからです。
同様の推論から、[Fe(CN)₆]³⁻イオンは1個だけの不対電子を伴う低スピン錯体であり、[Fe(H₂O)₆]³⁺と[FeF₆]³⁻イオンは5個の不対電子を伴う高スピン錯体であることがわかります。
例題19.7 高スピン錯体と低スピン錯体
不対電子の数を予測してください。
(a)K₃[CrI₆]
(b)[Cu(en)₂(H₂O)₂]Cl₂
(c)Na₃[Co(NO₂)₆]
解法
錯体は八面体形です。
(a)Cr³⁺はd³の配置をしています。これらの電子はすべて不対になります。
(b)Cu²⁺はd⁹なので、不対電子が1個あります。
(c)Co³⁺はd⁶の価電子を持っているので、結晶場分裂によって何個の電子が対になっているかが決まります。亜硝酸配位子は強電場配位子なので、この錯体は低スピンになります。6個の電子がt2g軌道に入り、不対のものは0個です。
学習内容の確認
結晶場分裂の大きさが電子の配置に影響を与えるのは、電子を対にするか、高エネルギー軌道を満たすかの選択肢がある場合だけです。八面体形の錯体の高スピン配置と低スピン配置の間に違いが出るのはどのd電子配置でしょうか?
解答:d⁴、d⁵、d⁶、およびd⁷
例題19.8 他の幾何構造についてのCFT
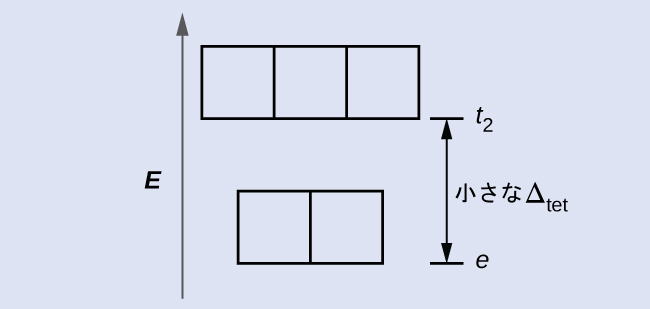
CFTは八面体形以外の幾何構造の分子にも適用できます。八面体形の錯体では、eg 集合の葉が直接配位子に向いていたことを思い出してください。四面体形の錯体の場合、d軌道はそのままですが、軸の間には4つの配位子しかありません(図19.36)。どの軌道も四面体形の配位子に直接向いていません。しかしながら、(直交軸に沿った)eg集合は、t2g集合よりも配位子との重なりが少ないです。八面体形の場合との類推から、四面体形の結晶場のd軌道についてのエネルギー図を予測してください。混乱を避けるために、八面体形のeg集合は四面体形のe集合になり、八面体形のt2g集合はt2集合になります。
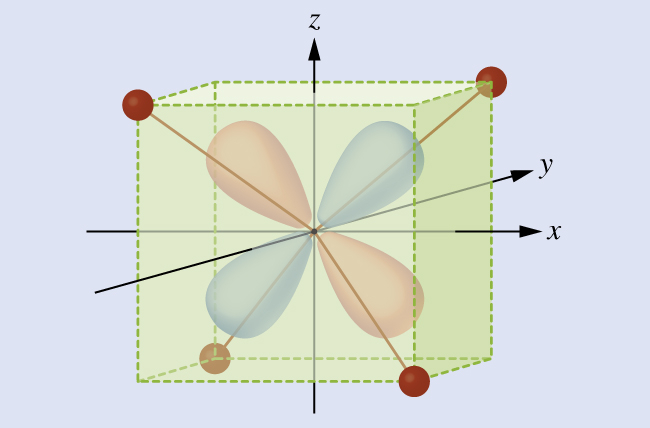
図19.36 | この図は、軌道の軸系に対する四面体形配位子の配向を示しています。
解法
CFTは静電反発力に基づいているため、配位子に近い軌道は不安定化し、他の集合の軌道と比較してエネルギーが上昇します。重なりが少ないため、分裂は八面体形錯体の場合よりも少なく、Δtetは通常は小さいです(Δtet = 4/9 Δoct):
学習内容の確認
四面体形のd⁴イオンがいくつの不対電子を持つか説明してください。
解答:4個です。Δtetが小さいので、すべての四面体錯体は高スピンであり、電子は対になる前にt2軌道に入ります。
もう1つの一般的な幾何構造は、平面四角形です。平面四角形の幾何構造は、一対のトランス配位子が除去された八面体構造と考えることができます。除去された配位子はz軸上にあると仮定します。これは、z軸上またはその近傍の軌道がより安定になり、x軸またはy軸上またはその近傍の軌道がより不安定になるように、d軌道の分布を変化させます。この結果、八面体形のt2g集合とeg集合が分裂して、以下に描かれるような、より複雑なパターンとなります:
分子とイオンの磁気モーメント
磁気測定の実験的証拠は、高スピン錯体・低スピン錯体の理論を支持しています。O₂のような不対電子を含む分子は常磁性であることを思い出してください。常磁性体は磁場に引き寄せられます。多くの遷移金属錯体は不対電子を持ち、それゆえに常磁性です。不対電子を含まないN₂のような分子やNa⁺、[Fe(CN)₆]⁴⁻のようなイオンは反磁性です。反磁性体は磁場によってわずかに反発される傾向があります。
原子やイオンの中の電子が不対になると、そのスピンによる磁気モーメントによって、原子やイオン全体が常磁性になります。不対電子を含む系の磁気モーメントの大きさは、不対電子の数に直接関係しており、不対電子の数が多ければ多いほど磁気モーメントは大きくなります。そのため、観測された磁気モーメントを用いて、存在する不対電子の数を決定することができます。低スピンd⁶[Fe(CN)₆]⁴⁻の磁気モーメントを測定したところ、鉄が反磁性であることが確認されました。一方で、高スピンd⁶[Fe(H₂O)₆]²⁺には4個の不対電子があり、この配置を支持する磁気モーメントを持っています。
遷移金属錯体の色
原子や分子が適切な周波数の光を吸収すると、それらの電子はより高いエネルギーの軌道に励起されます。多くの主族原子や分子では、吸収された光子は、人間の目では検出することのできない電磁スペクトルの紫外領域にあります。配位化合物では、d軌道間のエネルギー差により、しばしば可視領域の光子を吸収することができます。
人間の目は、太陽光の中に存在する割合のすべての色の混合物を白色光として認識します。補色(色相環上で互いに向かい合って位置する色)も色覚に用いられます。目は、適切な割合の2つの補色の混合物を白色光として認識します。同様に、ある色が白色光から欠落している場合、目にはその補色が見えます。たとえば、白色光から赤色の光子が吸収されると、目には緑の色が見えます。白色光から紫色の光子が取り除かれると、目にはレモンイエローの色が見えます。[Cu(NH₃)₄]²⁺イオンの青色は、このイオンがオレンジ色と赤色の光を吸収して青色と緑色の補色を残すことに起因します (図19.37)。
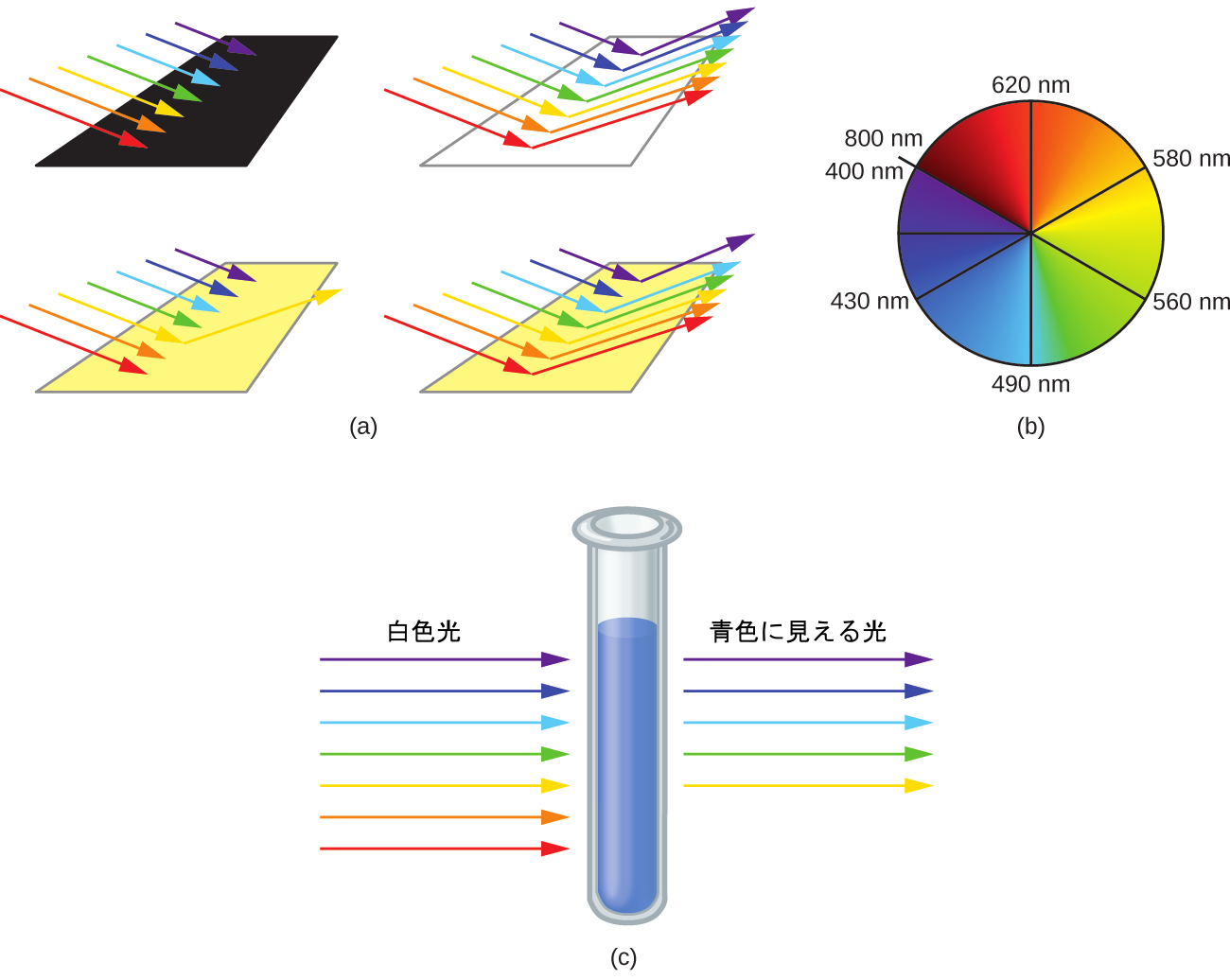
図19.37 | (a)ある物体は、全ての色の光を吸収するならば黒色です。もしそれがすべての色の光を反射するならば白色です。ある物体が1色を除いてすべての色を吸収するならば、それには色があります(この黄色の帯のように)。この黄色の帯はまた、白色光から黄色の補色(この場合は藍色)を吸収している場合にも黄色に見えます。(b)補色は、色相環上で互いに真向かいに位置しています。(c)[Cu(NH₃)₄]²⁺イオンの溶液は赤色とオレンジ色の光を吸収するので、透過した光は補色の青色に見えます。
例題19.9 錯体の色
八面体形の錯体[Ti(H₂O)₆]³⁺は単一のd電子を持っています。この電子を基底状態のt2g軌道からeg軌道に励起するために、この錯体は450~600nmの光を吸収します。最大吸光度はΔoctに相当し、499nmで生じます。Δoctの値をジュールで計算し、溶液の色がどのように見えるかを予測してください。
解法
プランクの方程式を使って(電磁エネルギーの項を参照)、計算すると:
\[ ν =\frac{c}{λ}\ よって\ \frac{\rm 3.00 × 10^8\ m/s}{\rm \frac{499\ nm× 1\ m}{10^9\ nm}}= 6.01 × 10^{14}\ {\rm Hz}\\ E = hν\ よって\ \rm 6.63 × 10^{−34}\ J·s× 6.01 × 10^{14}\ Hz = 3.99 × 10^{−19}\ ジュール/イオン \]
錯体は600nm(オレンジ色)から450nm(青色)を吸収するので、藍色、紫色、赤色の波長が透過し、この錯体は紫色に見えるでしょう。
学習内容の確認
緑色に見える錯体は、どの波長の光子を吸収するのでしょうか?
解答:赤色、620~800 nm
電子が遷移する軌道の相対的なエネルギーのわずかな変化が、吸収される光の色を劇的に変化させることがあります。したがって、配位化合物の色は多くの要因に依存します。図19.38に示されるように、異なる水溶性金属イオンは異なる色を持つことができます。さらに、下のリンクのバナジウム錯体の場合に示されているように、1つの金属の異なる酸化状態は、異なる色を作り出すことがあります。

図19.38 | 安定なイオンCr³⁺(aq)、Fe³⁺(aq)、Co²⁺(aq)(左側、中央、右側)の部分的に満たされたd軌道が、さまざまな色を生み出しています。(credit: Sahar Atwa)
中心金属に配位した特定の配位子も、配位錯体の色に影響を与えます。たとえば、鉄(II)錯体[Fe(H₂O)₆]SO₄は、この高スピン錯体が赤色の波長の光子を吸収するために、青緑色に見えます(図19.39)。対照的に、低スピンの鉄(II)錯体K₄[Fe(CN)₆]は、より高エネルギーの紫色の光を吸収するために、淡い黄色に見えます(図19.39)。

図19.39 | (a)ヘキサアクア鉄(II)硫酸塩と(b)ヘキサシアノ鉄(II)酸カリウムはどちらもd⁶鉄(II)八面体形の中心金属を含みますが、それらは可視スペクトルの異なる範囲の光子を吸収します。
学習へのリンク
バナジウム錯体の還元のビデオ(http://openstaxcollege.org/l/16vanadium)を見て、酸化状態の変化によるカラフルな効果を観察してください。
一般的に、強電場配位子は、中心の金属原子のd軌道のエネルギーに大きな分裂を引き起こします(大きなΔoct)。このような配位子を持つ遷移金属配位化合物は、より高いエネルギーの紫色や青色の光を吸収するため、黄色、オレンジ色、または赤色などの色をしています。一方、弱電場配位子を持つ遷移金属の配位化合物は、エネルギーの低い黄色、オレンジ色、または赤色の光を吸収するため、しばしば青緑色、青色、または藍色になります。
Cu⁺イオンの配位化合物はd¹⁰配置であり、すべての eg 軌道が満たされています。電子を4p軌道のようなさらに高い準位に励起するためには、非常に高いエネルギーの光子が必要です。このエネルギーは、スペクトルの紫外領域の非常に短い波長に相当します。可視光は吸収されないので、目で変化を見ることはできず、化合物は白色または無色に見えます。たとえば、[Cu(CN)₂]⁻を含む溶液は無色です。一方、八面体形のCu²⁺錯体は、eg軌道に空きがあり、電子はこの準位まで励起することができます。吸収される光の波長(エネルギー)はスペクトルの可視部分に対応し、Cu²⁺錯体はほとんど常に、青色、青緑がかった紫色、黄色といった色がついています(図19.40)。CFTは配位錯体の多くの性質を記述することに成功していますが、配位錯体の振る舞いを十分に理解するためには分子軌道の説明(ここで提供されている入門的な範囲を超えています)が必要です。

図19.40 | (a)CuIのようなd¹⁰配置を持つ銅(I)錯体は無色になる傾向がありますが、(b)Cu(NO₃)₂·5H₂Oのようなd⁹配置の銅(II)錯体は鮮やかな色をしています。
重要用語
アクチニド系列(または、アクチノイド系列):アクチニウムおよびfブロックの第2行の元素、原子番号89~103番
二座配位子:2つの異なる原子からの配位結合を介して1つの中心金属に配位する配位子
中心金属:1つかそれ以上の配位子が配位共有結合を介して結合したイオンまたは原子
キレート:中心金属に多座配位子が結合することで形成される錯体
キレート配位子:2つかそれ以上の供与体原子からの結合により中心金属イオンに結合する配位子
シス配置:分子の仮想的な基準線の同じ側に2つの類似した基がある幾何異性体の配置
配位化合物:中心の金属原子またはイオンがルイス酸として機能し、1つかそれ以上の電子対を受け入れる安定した化合物
配位化合物:ルイス酸-塩基相互作用を介して中心原子に結合した原子、分子、またはイオンからなる物質
配位数:錯体の中の中心金属原子への配位共有結合の数、または結晶形態の原子への最も近い接触の数
配位圏:錯体の中心金属原子またはイオンと、結合した配位子
結晶場分裂(Δoct):軌道のt2g 集合と eg 集合の間、または t 集合と e 集合の間のエネルギーの差
結晶場理論:遷移金属の軌道のエネルギーを配位子との静電相互作用の観点から説明する(ただし、金属と配位子との結合は含まない)モデル
dブロック元素:d軌道に価電子を持つ第3~11族の元素のうちの1つ
供与体原子:配位子の中の原子で、中心金属との間で配位共有結合を形成する孤立電子対を持つ原子
eg軌道:配位錯体の直交軸上に配向した2つのd軌道の集合。八面体形の錯体では、t2g 軌道よりもエネルギーが高い
fブロック元素(または、内部遷移元素):原子番号58~71番または90~103番の元素のうちの1つで、f軌道に価電子を持つ。周期表の下に別個に示されることが多い
第一遷移系列:周期表の第4周期(dブロックの第1行)の遷移元素、原子番号21~29番
第四遷移系列:周期表の第7周期(dブロックの第4行)の遷移元素、原子番号89番と104~111番
幾何異性体:原子が互いに相対的に空間内で配向する方法が異なる異性体で、異なる物理的・化学的性質につながる
高スピン錯体:2つの電子が低エネルギー軌道で対になる前に、電子がすべての軌道を単独で満たすことにより、電子の全スピンが最大になる錯体
湿式精錬:金属を最初に可溶性イオンに変え、そのイオンを抽出し、そして純粋な金属を沈殿させるためにそのイオンを還元することによって混合物から金属を分離するプロセス
イオン化異性体(または、配位異性体):アニオン性配位子が内側の配位圏の対イオンによって置き換えられた異性体
ランタニド系列(または、ランタノイド系列):ランタンおよびfブロックの第1行の元素、原子番号57~71番
配位子:配位化合物の中で中心金属イオンに結合したイオンまたは中性分子
結合異性体:遷移金属に2つの異なる方法で結合することのできる配位子を有する配位化合物(CN⁻とNC⁻)
低スピン錯体:電子が高エネルギー軌道を満たす前に低エネルギー軌道で対になることにより、電子の全スピンが最小になる錯体
単座配位子:ただ1つの配位共有結合を介して中心金属に結合する配位子
光学異性体(または、エナンチオマー):他の光学異性体と反応する場合を除いて同一の化学的・物理的性質を持つ、重ね合わせ不可能な鏡像である分子
対形成エネルギー(P):スピンが逆の2つの電子を単一の軌道に配置するのに必要なエネルギー
白金族金属:ルテニウム、オスミウム、ロジウム、イリジウム、パラジウム、白金からなる6個の遷移金属のグループで、同じ鉱物中に存在し、類似の化学的性質を示す傾向がある
多座配位子:2つかそれ以上の供与体原子からの結合によって中心金属イオンに結合する配位子で、いくつの供与体が存在するかを示す接頭辞を付けて命名される(たとえば、六座 = 6つの配位結合が形成される)
希土類元素:ランタニド、スカンジウム、イットリウムを含む17個の元素の集まりで、しばしば一緒に存在し、類似の化学的性質を有するため、分離が困難である
第二遷移系列:周期表の第5周期(dブロックの第2行)の遷移元素、原子番号39~47番
製錬:溶融した鉱石から純粋な金属を抽出するプロセス
分光化学系列:配位子が引き起こす結晶場分裂の大きさによる配位子のランク付け
鉄鋼:鉄の中の不純物を除去し、特定の用途に適した性質を持つ合金を作るような物質を添加することによって、鉄から作られる材料
強電場配位子:大きな結晶場分裂を引き起こす配位子
超伝導体:抵抗なしに電気を通す物質
t2g軌道:配位錯体の直交軸の間に配置された3つのd軌道の集合。CFTによると、八面体形の錯体では、eg軌道に比べてエネルギーが低い
第三遷移系列:周期表の第6周期(dブロックの第3行)の遷移元素、原子番号57番と72~79番
トランス配置:分子の仮想的な基準線の反対側に2つの類似した基がある幾何異性体の配置
弱電場配位子:小さな結晶場分裂を引き起こす配位子
この章のまとめ
19.1 遷移金属とその化合物の産出・調製・性質
遷移金属は、周期表のdブロックに位置する、d軌道が部分的に満たされた元素です。遷移金属の反応性は、スカンジウムや鉄のような非常に活性の高い金属から、白金族金属のようなほとんど不活性な元素まで、大きく異なります。鉱石から元素を単離する際に使用される化学的な性質の種類は、その鉱石中の元素の濃度と元素のイオンを金属に還元することの難しさに依存します。より活性の高い金属は、還元するのがより困難です。
遷移金属は、金属に典型的な化学的振る舞いを示します。たとえば、それらは加熱すると空気中で酸化し、元素のハロゲンと反応してハロゲン化物を形成します。活性系列で水素より上にある元素は、酸と反応して塩と水素気体を生成します。低い酸化状態の遷移金属化合物の酸化物、水酸化物、炭酸塩は塩基性です。ハロゲン化物や他の塩は、一般的には水中で安定ですが、場合によっては酸素を排除しなければなりません。ほとんどの遷移金属はさまざまな安定な酸化状態を形成し、幅広い化学反応性を示すことができます。
19.2 遷移金属の配位化学
遷移元素と主族元素は配位化合物、すなわち錯体を形成することができます。その中では、中心の金属原子またはイオンが、1つかそれ以上の配位子に配位共有結合で結合しています。複数の供与体原子を持つ配位子は多座配位子と呼ばれ、キレートを形成します。錯体に見られる一般的な幾何構造は、四面体形と平面四角形(いずれも配位数4)と八面体形(配位数6)です。いくつかの八面体形および平面四角形の錯体では、シス配置およびトランス配置が可能です。これらの幾何異性体に加えて、ある種の八面体形の錯体においては、光学異性体(鏡像ではあるが、重ね合わせ可能ではない分子またはイオン)が可能です。配位錯体は、血液中の酸素輸送、水の浄化、医薬品としての利用など、幅広い用途があります。
19.3 配位化合物の分光学的・磁気的性質
結晶場理論では、金属の電子と配位子との間の相互作用を単純な静電効果として扱います。金属イオンの近くに配位子が存在すると、金属のd軌道のエネルギーが遊離イオンのエネルギーに比べて変化します。錯体の色や磁気特性は、この結晶場分裂に起因しています。分裂の大きさ(Δoct)は、金属に結合している配位子の性質に依存します。強電場配位子は大きな分裂を生じさせ、電子がeg軌道を占める前にt2g軌道が完全に満たされるような低スピン錯体の形成に有利に働きます。弱電場配位子は高スピン錯体の形成に有利に働きます。この場合、t2gとegの軌道は、いずれかの軌道が二重に占有される前に単独で占有されます。
練習問題
19.1 遷移金属とその化合物の産出・調製・性質
1.以下のそれぞれの元素についての電子配置を書いてください:
(a)Sc
(b)Ti
(c)Cr
(d)Fe
(e)Ru
2.以下の元素とそのイオンのそれぞれについての電子配置を書いてください:
(a)Ti
(b)Ti²⁺
(c)Ti³⁺
(d)Ti⁴⁺
3.以下の元素とその3+イオンのそれぞれについての電子配置を書いてください:
(a)La
(b)Sm
(c)Lu
4.ランタノイド元素が自然界に元素の形態で存在しないのはなぜですか?
5.以下の元素のうち、La₂O₃の還元によりLaを調製するために使われる可能性が最も高いものはどれですか:Al、C、Fe?それはなぜですか?
6.以下のうち、最も強い酸化剤はどれですか:VO₄³⁻、CrO₄²⁻、MnO₄⁻?
7.以下の元素のうち、MO₃の化学式で酸化物を形成する可能性が最も高いものはどれですか:Zr、Nb、Mo?
8.高炉では以下の反応がすべて起こります。これらのうち、酸化-還元反応であるのはどれですか?
(a)3Fe₂O₃(s) + CO(g) ⟶ 2Fe₃O₄(s) + CO₂(g)
(b)Fe₃O₄(s) + CO(g) ⟶ 3FeO(s) + CO₂(g)
(c)FeO(s) + CO(g) ⟶ Fe(l) + CO₂(g)
(d)C(s) + O₂(g) ⟶ CO₂(g)
(e)C(s) + CO₂(g) ⟶ 2CO(g)
(f)CaCO₃(s) ⟶ CaO(s) + CO₂(g)
(g)CaO(s) + SiO₂(s) ⟶ CaSiO₃(l)
9.なぜ鉄の製錬中におけるスラグの形成が有用なのですか?
10.酸化マンガン(VII)水溶液のpHは7.0超だと予想しますか、7.0未満だと予想しますか?あなたの答えが正当である根拠を示してください。
11.鉄(II)は重クロム酸イオンによって鉄(III)に酸化され、重クロム酸イオンは酸性溶液中でクロム(III)に還元されます。鉄鉱石の試料2.5000gを溶解し、鉄を鉄(II)に変換します。滴定には0.0100 MのNa₂Cr₂O₇が正確に 19.17 mL 必要でした。鉱石の試料の鉄の割合は何%でしたか?
12.高炉でFe₂O₃を鉄に変換するためには、Fe₂O₃の1トンあたり、圧力760 torr、0 °Cの空気が何立方フィート必要ですか?この練習問題では、空気は体積で19%が酸素であると仮定してください。
13.以下の電気化学電池の電位を求めてください:
Cd | Cd²⁺, M = 0.10 ‖ Ni²⁺, M = 0.50 | Ni
14.純粋な固体アルカリ金属塩化物2.5624 gの試料を水に溶かし、過剰な硝酸銀で処理しました。得られた沈殿物を濾過して乾燥させた後の重量は 3.03707 g でした。元の化合物中の塩化物イオンの質量での割合は何%でしたか?また、その塩の正体は何ですか?
15.反応[Co(H₂O)₆]³⁺(aq) + e⁻⟶ [Co(H₂O)₆]²⁺(aq)の標準還元電位は約1.8 Vです。反応[Co(NH₃)₆]³⁺(aq) + e⁻⟶ [Co(NH₃)₆]²⁺(aq)の還元電位は+0.1 Vです。錯イオン[Co(H₂O)₆]²⁺および/または[Co(NH₃)₆]²⁺が酸素によって対応するコバルト(III)錯体に酸化されるかどうかを示すために、電池電位を計算してください。
16.以下のそれぞれの反応の生成物を予測してください。(注:本章の情報を利用することに加えて、反応生成物の予測に関する情報も含め、現段階までの学習で蓄積してきた知識を活用してください。)
(a)MnCO₃(s) + HI(aq) ⟶
(b)CoO(s) + O₂(g) ⟶
(c)La(s) + O₂(g) ⟶
(d)V(s) + VCl₄(s) ⟶
(e)Co(s) + xsF₂(g) ⟶
(f)CrO₃(s) + CsOH(aq) ⟶
17.以下のそれぞれの反応の生成物を予測してください。(注:本章の情報を利用することに加えて、反応生成物の予測に関する情報も含め、現段階までの学習で蓄積してきた知識を活用してください。)
(a)Fe(s) + H₂SO₄(aq) ⟶
(b)FeCl₃(aq) + NaOH(aq) ⟶
(c)Mn(OH)₂(s) + HBr(aq) ⟶
(d)Cr(s) + O₂(g) ⟶
(e)Mn₂O₃(s) + HCl(aq)⟶
(f)Ti(s) + xsF₂(g) ⟶
18.銅を精錬するための電解プロセスを記述してください。
19.以下の反応の生成物を予測し、反応式のバランスを取ってください。
(a)酸の中のCr₂(SO₄)₃の溶液に、Znを加える。
(b)塩酸の中にCr₂O₇²⁻を過剰に含む溶液に、FeCl₂を加える。
(c)酸性溶液の中のCr₂O₇²⁻に、Cr²⁺を加える。
(d)MnをCrO₃とともに加熱する。
(e)水中の2HNO₃に、CrOを加える。
(f)NaOHの水溶液に、FeCl₃を加える。
20.硫化鉄(II)を非酸化性の酸で処理したときに発生する気体は何ですか?
21.以下のそれぞれの反応の生成物を予測し、化学反応式のバランスを取ってください。
(a)Feを水蒸気雰囲気中で加熱する。
(b)Fe(NO₃)₃の溶液に、NaOHを加える。
(c)KMnO₄の酸性溶液に、FeSO₄を加える。
(d)H₂SO₄の希薄溶液に、Feを加える。
(e)Fe(NO₃)₂とHNO₃の溶液を大気中に放置する。
(f)HClO₄の溶液に、FeCO₃を加える。
(g)Feを空気中で加熱する。
22.以下の反応式を酸化-還元法によってバランスを取ってください。3つの元素は酸化状態が変化することに注意してください。
Co(NO₃)₂(s) ⟶ Co₂O₃(s) + NO₂(g) + O₂(g)
23.希薄なシアン化ナトリウム溶液を、ゆっくりと撹拌した硝酸銀溶液にゆっくりと滴下します。一時的に白い沈殿物ができますが、シアン化ナトリウムの添加が続くにつれて溶解します。この観察結果を化学反応式を用いて説明してください。シアン化銀はその溶解度の点において塩化銀に似ています。
24.[CrO₄]²⁻と[WO₄]²⁻のどちらがより安定であるかを予測し、説明してください。
25.以下の第一遷移系列の酸化物のそれぞれについて、金属の酸化状態を示してください。(ヒント:化学式M₃O₄の酸化物は、金属イオンが複数の酸化状態で存在する混合原子価化合物の例です。これらの化合物の化学式を同等の形式MO·M₂O₃と書くことで、金属の2つの酸化状態を推定することができます。)
(a)Sc₂O₃
(b)TiO₂
(c)V₂O₅
(d)CrO₃
(e)MnO₂
(f)Fe₃O₄
(g)Co₃O₄
(h)NiO
(i)Cu₂O
19.2 遷移金属の配位化学
26.以下のそれぞれの配位化合物の中心金属原子の配位数を示してください:
(a)[Pt(H₂O)₂Br₂]
(b)[Pt(NH₃)(py)(Cl)(Br)] (py = ピリジン、C₅H₅N)
(c)[Zn(NH₃)₂Cl₂]
(d)[Zn(NH₃)(py)(Cl)(Br)]
(e)[Ni(H₂O)₄Cl₂]
(f)[Fe(en)₂(CN)₂] + (en = エチレンジアミン、C₂H₈N₂)
27.以下のそれぞれについて、配位数を示し、その化学式を(適切な場合にはすべての異性体を含めて)書いてください:
(a)テトラヒドロキソ亜鉛(II)酸イオン(四面体形)
(b)ヘキサシアノパラジウム(IV)酸イオン
(c)ジクロロ金(I)酸イオン(aurumはラテン語で「金」を意味することに注意してください)
(d)ジアンミンジクロロ白金(II)
(e)ジアンミンテトラクロロクロム(III)酸カリウム
(f)ヘキサアンミンコバルト(III)ヘキサシアノクロム(III)酸塩
(g)ジブロモビス(エチレンジアミン)コバルト(III)硝酸塩
28.以下の化合物のそれぞれの金属イオンについて配位数を示してください:
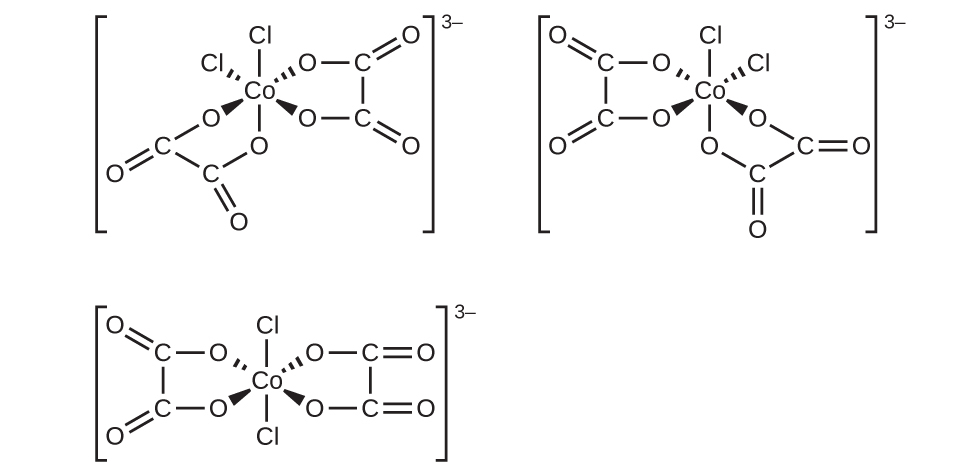
(a)[Co(CO₃)₃]³⁻ (この錯体の中ではCO₃²⁻は二座であることに注意してください)
(b)[Cu(NH₃)₄]²⁺
(c)[Co(NH₃)₄Br₂]₂(SO₄)₃
(d)[Pt(NH₃)₄][PtCl₄]
(e)[Cr(en)₃] (NO₃)₃
(f)[Pd(NH₃)₂Br₂] (平面四角形)
(g)K₃[Cu(Cl)₅]
(h)[Zn(NH₃)₂Cl₂]
29.以下の錯体の構造をスケッチしてください。シス異性体、トランス異性体、光学異性体があれば示してください。
(a)[Pt(H₂O)₂Br₂] (平面四角形)
(b)[Pt(NH₃)(py)(Cl)(Br)] (平面四角形、py = ピリジン、C₅H₅N)
(c)[Zn(NH₃)₃Cl]⁺ (四面体形)
(d)[Pt(NH₃)₃Cl]⁺ (平面四角形)
(e)[Ni(H₂O)₄Cl₂]
(f)[Co(C₂O₄)₂Cl₂]³⁻ (C₂O₄²⁻は二座のシュウ酸イオン⁻O₂CCO₂⁻であることに注意してください)
30.以下のもの(enはエチレンジアミン)について存在しうるシス異性体、トランス異性体、光学異性体の図を描いてください:
(a)[Co(en)₂(NO₂)Cl]⁺
(b)[Co(en)₂Cl₂]⁺
(c)[Pt(NH₃)₂Cl₄]
(d)[Cr(en)₃]³⁺
(e)[Pt(NH₃)₂Cl₂]
31.練習問題19.28で与えられたそれぞれの化合物またはイオンの名前を挙げ、金属の酸化状態を示してください。
32.練習問題19.30で与えられたそれぞれの化合物またはイオンの名前を挙げてください。
33.以下の錯体が異性体を持つかどうかを特定してください。
(a)四面体形の[Ni(CO)₂(Cl)₂]
(b)三方両錐形の[Mn(CO)₄NO]
(c)[Pt(en)₂Cl₂]Cl₂
34.炭酸配位子CO₃²⁻が単座配位子、二座配位子、または三座配位子のいずれとして中心金属に配位するかを予測してください。
35.[CoCl₅CN][CN]の幾何異性体、結合異性体、イオン化異性体を描いてください。
19.3 配位化合物の分光学的・磁気的性質
36.結晶場理論の観点から、[Fe(NO₂)₆]³⁻と[FeF₆]³⁻について予測される不対電子の数を決定してください。
37.[Fe(NO₂)₆]⁴⁻と[FeF₆]³⁻の結晶場の図を描いてください。それぞれの錯体が高スピンであるか低スピンであるか、常磁性であるか反磁性であるかを述べ、それぞれの錯体についてのΔoctとPを比較してください。
38.[Co(NH₃)₆]Cl₃について、金属の酸化状態、d電子の数、予測される不対電子の数を示してください。
39.無水の固体CoCl₂は青色をしています。これは空気中の水分を容易に吸収するので、携帯電話などの機器が過度の湿度にさらされていないかどうかを監視するための湿度標識として使用されています。この反応によってどのような生成物が形成され、この錯体が何個の不対電子を持つかを予測してください。
40.遷移系列の金属の錯体が6個の不対電子を持つことは可能でしょうか?説明してください。
41.以下のそれぞれにおいて不対電子は何個ありますか?
(a)[CoF₆]³⁻ (高スピン)
(b)[Mn(CN)₆]³⁻ (低スピン)
(c)[Mn(CN)₆]⁴⁻ (低スピン)
(d)[MnCl₆]⁴⁻ (高スピン)
(e)[RhCl₆]³⁻ (低スピン)
42.二リン酸イオン[O₃P-O-PO₃]⁴⁻が、Fe²⁺が不溶性鉄塩として沈殿するのを防ぐ水軟化剤としてどのようにして機能するかを説明してください。
43.酸化数が変化しない同じ金属イオンの錯体では、t2g軌道の電子数が増えるほど安定性が増します。以下のそれぞれの錯体の組のうち、より安定している錯体はどちらですか?
(a)[Fe(H₂O)₆]²⁺ または [Fe(CN)₆]⁴⁻
(b)[Co(NH₃)₆]³⁺ または [CoF₆]³⁻
(c)[Mn(CN)₆]⁴⁻ または [MnCl₆]⁴⁻
44.トリメチルホスフィンP(CH₃)₃は、リン原子上の孤立電子対を供与することによって配位子として作用することができます。トリメチルホスフィンをアセトンの中の塩化ニッケル(II)の溶液に加えると、分子量が約270gで、21.5%のNi、26.0%のCl、52.5%のP(CH₃)₃を含む青色の化合物が単離されます。この青色の化合物には異性体の形態はありません。この青色化合物の幾何構造と分子式は何ですか?
45.錯体[Co(en)₃]Cl₃は不対電子を持つと予想しますか?異性体はありますか?
46.Mg₃[Cr(CN)₆]₂は、反磁性になると予想しますか、それとも常磁性になると予想しますか?あなたの推論を説明してください。
47.金(I)イオンAu⁺の塩は着色されていると予想しますか?説明してください。
48.[CuCl₄]²⁻は緑色です。[Cu(H₂O)₆]²⁺は青色です。どちらがより高いエネルギーの光子を吸収するでしょうか?どちらの方が結晶場分裂が大きいと予想しますか?
解答のヒント
1.(a) Sc: [Ar]4s²3d¹、(b) Ti: [Ar]4s²3d²、(c) Cr: [Ar]4s¹3d⁵、(d) Fe: [Ar]4s²3d⁶、(e) Ru: [Kr]5s²4d⁶
3.(a) La: [Xe]6s²5d¹、La³⁺: [Xe]、(b) Sm: [Xe]6s²4f⁶、Sm³⁺: [Xe]4f⁵、(c) Lu: [Xe]6s²4f¹⁴5d¹、Lu³⁺: [Xe]4f¹⁴
5.Alが使用されています。なぜなら、それは最も強い還元剤であり、La(III)をLaに変換するのに十分な駆動力を提供することのできる、挙げられた中で唯一の選択肢だからです。
7.Mo
9.CaSiO₃スラグは溶融された鉄よりも密度が低いため、容易に分離することができます。また、スラグ層が浮いていることで、溶融された鉄がO₂にさらされて酸化し、FeがFe₂O₃に戻るのを防ぐ障壁となります。
11.2.57%
13.0.167 V
15.E° = -0.6 V、E°は負の値なので、この還元は自発的ではありません。E° = +1.1 V
17.(a) Fe(s) + 2H₃O⁺(aq) + SO₄²⁻(aq) ⟶ Fe²⁺(aq) + SO₄²⁻(aq) + H₂(g) + 2H₂O(l)
(b) FeCl₃(aq) + 3Na⁺(aq) + 3OH⁻(aq) ⟶ Fe(OH)₃(s) + 3Na⁺(aq) + 3Cl⁻(aq)
(c) Mn(OH)₂(s) + 2H₃O⁺(aq) + 2Br⁻(aq) ⟶ Mn²⁺(aq) + 2Br⁻(aq) + 4H₂O(l)
(d) 4Cr(s) + 3O₂(g) ⟶ 2Cr₂O₃(s)
(e) Mn₂O₃(s) + 6H₃O⁺(aq) + 6Cl⁻(aq) ⟶ 2MnCl₃(s) + 9H₂O(l)
(f) Ti(s) + xsF₂(g) ⟶ TiF₄(g)
19.(a) Cr₂(SO₄)₃(aq) + 2Zn(s) + 2H₃O⁺(aq) ⟶ 2Zn²⁺(aq) + H₂(g) + 2H₂O(l) + 2Cr²⁺(aq) + 3SO₄²⁻(aq)
(b) 4TiCl₃(s) + CrO₄²⁻(aq) + 8H⁺(aq) ⟶ 4Ti⁴⁺(aq) + Cr(s) + 4H₂O(l) + 12Cl⁻(aq)
(c) pH 2とpH 6の間の酸性溶液では、CrO₄²⁻は重クロム酸イオンと平衡にあるHCrO₄⁻を形成します。この反応は
2HCrO₄⁻(aq) ⟶ Cr₂O₇²⁻(aq) + H₂O(l)
他の酸性pHでは、この反応は
3Cr²⁺(aq) + CrO₄²⁻(aq) + 8H₃O⁺(aq) ⟶ 4Cr³⁺(aq) + 12H₂O(l)
(d) \(\rm 8CrO_3(s) + 9Mn(s) \xrightarrow{Δ} 4Cr_2O_3(s) + 3Mn_3O_4(s)\)
(e) CrO(s) + 2H₃O⁺(aq) + 2NO₃⁻(aq) ⟶ Cr²⁺(aq) + 2NO₃⁻(aq) + 3H₂O(l)
(f) CrCl₃(s) + 3NaOH(aq) ⟶ Cr(OH)₃(s) + 3Na⁺(aq) + 3Cl⁻(aq)
21.(a) 3Fe(s) + 4H₂O(g) ⟶ Fe₃O₄(s) + 4H₂(g)
(b) 3NaOH(aq) + Fe(NO₃)₃(aq) → H₂O → Fe(OH)₃(s) + 3Na⁺(aq) + 3NO₃⁻(aq)
(c) MnO₄⁻ + 5Fe²⁺ + 8H⁺ ⟶ Mn²⁺ + 5Fe³⁺ + 4H₂O
(d) Fe(s) + 2H₃O⁺(aq) + SO₄²⁻(aq) ⟶ Fe²⁺(aq) + SO₄²⁻(aq) + H₂(g) + 2H₂O(l)
(e) 4Fe²⁺(aq) + O₂(g) + 4HNO₃(aq) ⟶ 4Fe³⁺(aq) + 2H₂O(l) + 4NO₃⁻(aq)
(f) FeCO₃(s) + 2HClO₄(aq) ⟶ Fe(ClO₄)₂(aq) + H₂O(l) + CO₂(g)
(g) \(\rm 3Fe(s) + 2O_2(g) \xrightarrow{Δ} Fe_3O_4(s)\)
23.CN⁻が加えられるにつれ、
Ag⁺(aq) + CN⁻(aq) ⟶ AgCN(s)
さらにCN⁻が加えられると
Ag⁺(aq) + 2CN⁻(aq) ⟶ [Ag(CN)₂]⁻(aq)
AgCN(s) + CN⁻(aq) ⟶ [Ag(CN)₂]⁻(aq)
25.(a) Sc³⁺、(b) Ti⁴⁺、(c) V⁵⁺、(d) Cr⁶⁺、(e) Mn⁴⁺、(f) Fe²⁺およびFe³⁺、(g) Co²⁺およびCo³⁺、(h) Ni²⁺、(i) Cu⁺
27.(a) 4、[Zn(OH)₄]²⁻、(b) 6、[Pd(CN)₆]²⁻、(c) 2、[AuCl₂]⁻、(d) 4、[Pt(NH₃)₂Cl₂]、(e) 6、K[Cr(NH₃)₂Cl₄]、(f) 6、[Co(NH₃)₆][Cr(CN)₆]、(g) 6、[Co(en)₂Br₂]NO₃
29.(a)[Pt(H₂O)₂Br₂]:
(b)[Pt(NH₃)(py)(Cl)(Br)]:
(c)[Zn(NH₃)₃Cl]⁺:
(d)[Pt(NH₃)₃Cl]⁺:
(e)[Ni(H₂O)₄Cl₂]:
(f)[Co(C₂O₄)₂Cl₂]³⁻:
31.(a)トリカルボナトコバルト(III)酸イオン、(b)テトラアンミン銅(II)イオン、(c)テトラアンミンジブロモコバルト(III)硫酸塩、(d)テトラアンミン白金(II)テトラクロロ白金(II)酸塩、(e)トリス(エチレンジアミン)クロム(III)硝酸塩、(f)ジアンミンジブロモパラジウム(II)、(g)ペンタクロロ銅(II)酸カリウム、(h)ジアンミンジクロロ亜鉛(II)
33.(a)なし、(b)なし、(c)2つのCl配位子はシスでもトランスでもありえます。それらがシスの場合、光学異性体も存在します。
35.
37.
39.3つの不対電子を持つ[Co(H₂O)₆]Cl₂
41.(a)4、(b)2、(c)1、(d)5、(e) 0
43.(a)[Fe(CN)₆]⁴⁻、(b)[Co(NH₃)₆]³⁺、(c) [Mn(CN)₆]⁴⁻
45.この錯体は不対電子を持ちません。この錯体は幾何異性体を持ちませんが、鏡像は重ね合わせ不可能であるため、光学異性体を持ちます。
47.いいえ。Au⁺は、完全な5d副準位を持っています。
[1] National Council against Health Fraud, NCAHF Policy Statement on Chelation Therapy, (Peabody, MA, 2002).
この訳文は元の本のCreative Commons BY 4.0ライセンスに従って同ライセンスにて公開します。問題がありましたら、可能な限り早く対応いたしますので、ご連絡ください。また、誤訳・不適切な表現等ありましたらご指摘ください。この本は、https://openstax.org/details/books/chemistry-2eで無料でダウンロードできます。