第4章 化学反応の化学量論

図4.1 | 現代のロケット燃料の多くは固体の物質の混合物であり、その量は慎重に測定されて組み合わされて、点火されると推力を発生させる化学反応を起こします。(credit: modification of work by NASA)
この章の概要
4.1 化学反応式を書き、バランスを取る
4.2 化学反応を分類する
4.3 反応の化学量論
4.4 反応の収率
4.5 定量的な化学分析
はじめに
固体燃料ロケットは、退役したスペースシャトルの後継機として米国航空宇宙局(NASA)が開発を進めている新しいスペース・ローンチ・システムを含め、世界の宇宙探査計画で中心的な役割を担っています(図4.1)。これらのロケットのエンジンは、慎重に調製された化学物質の固体混合物を正確に測定された量で組み合わせたものに依拠しています。この混合物に点火すると、強力な化学反応が起こり、大量の気体状の生成物が急速に生成されます。これらの気体は、ロケットエンジンのノズルから放出され、重い荷物を宇宙に打ち上げるのに必要な推進力を提供します。この化学反応の性質と、反応によって消費される物質および生成される物質の量の間の関係性との両方が、この技術の成功を左右する非常に重要な考慮事項です。この章では、化学反応式を用いて化学反応を記号化する方法、反応性のパターンを特定することにより、いくつかの一般的な化学反応を分類する方法、そして、化学反応に関与する物質の量の間の定量的な関係、すなわち反応の化学量論を決定する方法について説明します。
4.1 化学反応式を書き、バランスを取る
この節が終わるまでに、あなたは次のことができるようになります:
•化学反応の叙述的な説明から化学反応式を導き出す
•分子形式、全イオン形式、正味イオン形式で化学反応式を書き、バランスを取る
この教科書の以前の章では、個々の原子を表すために元素記号を使用することを紹介しました。原子がイオンとなるために電子を得たり失ったりするとき、あるいは分子を形成するために他の原子と結合するときには、それらの記号は、これらの種を適切に表す化学式を作り出すために変更されたり、結合されたりします。この記号法を拡張して、化学的(または物理的)変化を受ける物質の同一性と相対的な量の両方を表現するには、化学反応式を書いてバランスを取ることが必要とされます。例として、1個のメタン分子(CH₄)と2個の二原子酸素分子(O₂)が反応して、1個の二酸化炭素分子(CO₂)と2個の水分子(H₂O)を生成する場合を考えてみましょう。このプロセスを表す化学反応式が図4.2の上部に、空間充填分子モデルが図の下部に示されています。
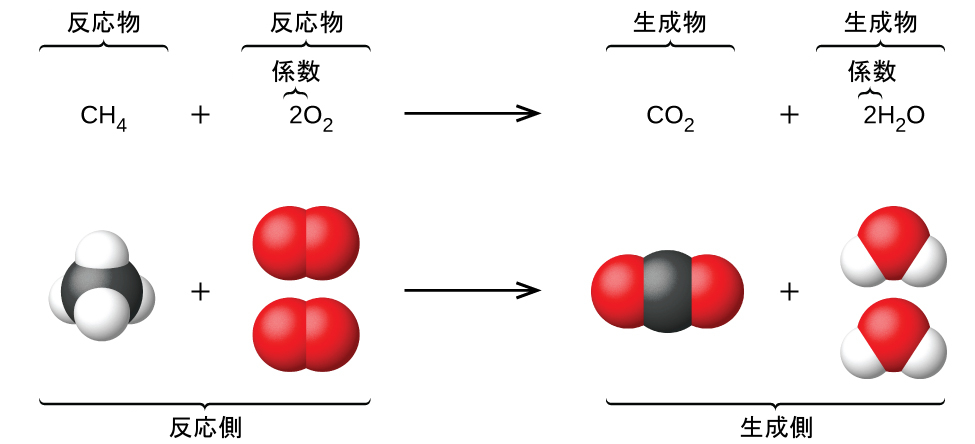
図4.2 | メタンと酸素が反応して二酸化炭素と水が生成する過程(下段)は、式(上段)を用いて化学反応式によって表現することができます。
この例は化学反応式の基本的な側面を示しています:
反応する物質は反応物と呼ばれ、その式は反応式の左側に置かれます。
反応によって生じる物質は生成物と呼ばれ、その式は反応式の右側に置かれます。
プラス記号(+)は個々の反応物と生成物の式を分け、矢印(⟶)は反応側と生成側(左側と右側)の式を分けます。
反応物と生成物の種類の相対的な数は、係数(それぞれの式のすぐ左に配置された数字)によって表されます。係数の1は通常は省略されます。
この例で行われているように、化学反応式では可能な限り小さい整数の係数を使用するのが一般的なやり方です。しかしながら、これらの係数は反応物と生成物の相対的な数を表しており、したがって、それらは正しくは比率として解釈されるものであることに注意してください。メタンと酸素が反応して二酸化炭素と水が得られます(1:2:1:2の比率で)。これらの分子の数がそれぞれ 1-2-1-2、または2-4-2-4、または3-6-3-6、などであれば、この比率は満たされます(図4.3)。同様に、これらの係数は、任意の量(数)の単位に関連させて解釈することができるので、この反応式は以下のように多くの方法で正しく読み取ることができます:
1個のメタン分子と2個の酸素分子が反応して、1個の二酸化炭素分子と2個の水分子が得られる。
1ダースのメタン分子と2ダースの酸素分子が反応して、1ダースの二酸化炭素分子と2ダースの水分子が得られる。
1モルのメタン分子と2モルの酸素分子が反応して、1モルの二酸化炭素分子と2モルの水分子が得られる。
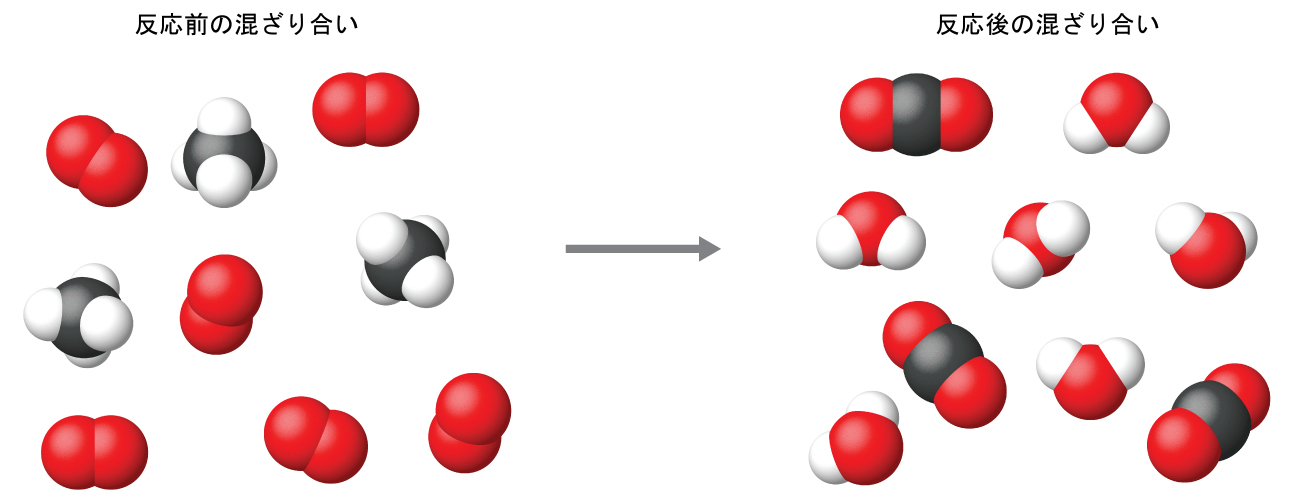
図4.3 | 分子の絶対的な数にかかわらず、反応するそれぞれの種の分子(反応物)の数と、形成されるそれぞれの種の分子(生成物)の数の比率は同じであり、化学反応式によって与えられます。
反応式のバランスを取る
4.1節で述べた化学反応式は、バランスが取れています。バランスが取れているとは、反応に関与するそれぞれの元素の原子の数が、反応側と生成側で等しく表現されていることを意味します。これは物質の保存の法則と一致するために反応式が満たさなければならない要件です。これは、矢印の両側の原子の数を単純に合計し、それらを比較して、それらの合計が等しいことを確認することによって裏付けることができるでしょう。所与の元素の原子の数は、その元素を含む式の係数に式の中の元素の添え字を掛けることによって計算することに注意してください。ある元素が反応式のいずれかの側で複数の式に含まれている場合、それぞれの式で表される原子の数を計算し、合計しなければなりません。たとえば、例として示した反応の生成物の種であるCO₂とH₂Oには両方とも酸素という元素が含まれているため、反応式の生成側の酸素原子の数は以下のようになります。
\[ \rm \left(1\ CO_2\ 分子×\frac{2\ O\ 原子}{CO_2\ 分子}\right)+\left(2\ H_2 O\ 分子×\frac{1\ O\ 原子}{H_2 O\ 分子}\right)= 4\ O\ 原子 \]
以下に示されるように、メタンと酸素が反応して二酸化炭素と水が得られる反応における反応式は、このアプローチに従ってバランスが取れていることが確認されます:
\[ \rm CH_4 + 2O_2 ⟶ CO_2 + 2H_2 O \]

バランスの取れた化学反応式は、検査によるバランシングとして知られているかなり単純な方法によって、ある化学反応の定性的な記述から導き出されることがしばしばあります。例として、水が分解されて分子の水素と酸素が生成されることを考えてみましょう。このプロセスは、バランスが取れていない(アンバランスな)化学反応式によって、定性的に表されます:
\[ \rm H_2 O ⟶ H_2 + O_2 (アンバランス) \]
この反応式の両側のHとOの原子の数を比較すると、その不均衡を確認することができます:

反応式の反応側と生成側のH原子の数は同じですが、O原子の数は同じではありません。バランスを取るために、必要に応じて反応式の係数を変更することができます。もちろん、式の添え字は物質の同一性を部分的に定義しているので、反応式の定性的な意味を変更せずに式の添え字を変えることはできないことに留意してください。たとえば、反応物の式をH₂OからH₂O₂に変更すると、原子の数のバランスは取れるかもしれませんが、そうすると反応物の同一性が変わります(水ではなく過酸化水素になってしまいます)。O原子のバランスは、H₂Oの係数を2に変更することによって達成されるでしょう。
\[ \rm 2H_2 O ⟶ H_2 + O_2 (アンバランス) \]

この変更によりH原子のバランスが崩れましたが、生成物のH₂の係数を2に変更することによって簡単に元通りになります。
\[ \rm 2H_2 O ⟶ 2H_2 + O_2 (バランス) \]

これらの係数は、反応側と生成側でH原子とO原子の両方の数を等しくします。したがって、バランスの取れた反応式は、以下のようになります:
\[ \rm 2H_2 O ⟶ 2H_2 + O_2 \]
例題4.1 化学反応式のバランスを取る
分子の窒素(N₂)と酸素(O₂)が五酸化二窒素を形成する反応についてのバランスの取れた反応式を書いてください。
解法
まず、バランスの取れていない反応式を書きます。
\[ \rm N_2 + O_2 ⟶ N_2 O_5(アンバランス) \]
次に、バランスの取れていない反応式に存在する原子のそれぞれの種類の数を数えます。

窒素はバランスが取れていますが、酸素原子の数のバランスを取るためには係数の変更が必要です。酸素原子の数のバランスを取るためには、O₂とN₂O₅の係数を10個のO原子(これらの2つの式のO原子の添え字の最小公倍数)が得られる整数に変更することが妥当な最初の試みでしょう。
\[ \rm N_2 + 5O_2 ⟶ 2N_2 O_5 (アンバランス) \]

この変更によってN原子のバランスが崩れますが、反応物N₂の係数を2に変更することによって元に戻ります。
\[ \rm 2N_2 + 5O_2 ⟶ 2N_2 O_5 \]

これで、反応式の両側にあるN原子とO原子の数は等しくなり、反応式はバランスが取れていることになります。
学習内容の確認
硝酸アンモニウムが分解して窒素分子、酸素分子、水を形成する反応についてのバランスの取れた反応式を書いてください。(ヒント:酸素は反応式の右側の複数の分子に存在するので、最後にバランスを取ってください。)
解答:2NH₄NO₃ ⟶ 2N₂ + O₂ + 4H₂O
化学反応式のバランスを取る過程で、中間係数として整数の代わりに分数を使用すると便利な場合があります。バランスが取れたら、反応式のすべての係数に整数を掛けて、原子のバランスを崩さずに分数の係数を整数に変換することができます。たとえば、エタン(C₂H₆)と酸素を反応させてH₂OとCO₂を生成する場合を考えてみましょう。これはバランスの取れていない反応式によって以下のように表されます:
\[ \rm C_2 H_6 + O_2 ⟶ H_2 O + CO_2 (アンバランス) \]
通常の検査のアプローチにしたがって、まず、以下に示されるように2つの生成物の種類の係数を変更することによって、C原子とH原子のバランスを取ることができます:
\[ \rm C_2 H_6 + O_2 ⟶ 3H_2 O + 2CO_2 (アンバランス) \]
この結果、反応式の生成側には7つのO原子があることになります。7は奇数であり、反応物のO₂で整数の係数を使用して奇数を得ることはできません。そこで、代わりに分数の係数7/2を使用して暫定的にバランスの取れた反応式を得ることができます:
\[ \rm C_2 H_6 +\frac{7}{2}O_2 ⟶ 3H_2 O + 2CO_2 \]
それぞれの係数に2を掛けることによって、整数のみの係数を持つ従来のバランスの取れた反応式が導出されます:
\[ \rm 2C_2 H_6 + 7O_2 ⟶ 6H_2 O + 4CO_2 \]
最後に、バランスの取れた反応式については、慣例では最小の整数の係数を使用することを思い出してください。窒素分子と水素分子が反応してアンモニアを生成する反応式は確かにバランスが取れています。
\[ \rm 3N_2 + 9H_2 ⟶ 6NH_3 \]
しかし、係数は反応分子と生成分子の相対的な数を表す最小の整数ではありません。それぞれの係数を最大公約数である3で割ると、好ましい式が得られます:
\[ \rm N_2 + 3H_2 ⟶ 2NH_3 \]
学習へのリンク
反応式のバランスを取るための追加の練習には、このインタラクティブなチュートリアル(http://openstaxcollege.org/l/16BalanceEq)を使用してください。
化学反応式における追加の情報
化学反応式の反応物と生成物の物理的状態は、非常に多くの場合で、式の後に補足的な略語で示されています。一般的な略語には、固体を表すs、液体を表すl、気体を表すg、そして水に溶解している物質(前章で紹介した水溶液)を表すaqが含まれます。これらの表記法をここでは例としての反応式で説明します:
\[ \rm 2Na\ (s) + 2H_2 O\ (l) ⟶ 2NaOH\ (aq) + H_2\ (g) \]
この反応式は、金属ナトリウムを水の中に入れたときに起こる反応を表しています。固体のナトリウムは液体の水と反応して水素分子の気体とイオン化合物の水酸化ナトリウム(純粋な形態では固体ですが、水に溶けやすいです)を生成します。
反応に必要な特別な条件は、反応式の矢印の上や下に文字や記号を書いて指定することがあります。たとえば、加熱することによって行われる反応は、矢印の上にギリシャ文字の大文字のデルタ(Δ)で示されることがあります。
\[ \rm CaCO_3\ (s) \xrightarrow{Δ} CaO\ (s) + CO_2\ (g) \]
これらの特別な条件の他の例については、後の章で詳しく説明します。
イオン反応の反応式
地球上に水が豊富にあることを考えると、多くの化学反応が水という媒体の中で行われているのは当然のことです。これらの反応にイオンが関与している場合、化学反応式は目的とする用途に応じてさまざまなレベルの詳細を記述することができます。これを説明するために、水溶液の中で行われるイオン化合物間の反応について考えてみましょう。CaCl₂とAgNO₃の水溶液を混合すると、水溶性のCa(NO₃)₂と固体のAgClが生成する反応が起こります:
\[ \rm CaCl_2\ (aq) + 2AgNO_3\ (aq) ⟶ Ca(NO_3)_2\ (aq) + 2AgCl\ (s) \]
通常の方法で導き出されたこのバランスが取れた反応式は、溶液中に存在するイオンの種類を明示的に表現していないため、分子反応式と呼ばれます。イオン化合物が水に溶解すると、それらはその構成イオンへと解離し、その後、イオンは溶液中に均一に分散します(この重要なプロセスについての詳しい議論は、溶液に関する章で与えられています)。したがって、水に溶けているイオン化合物は、より現実的には解離イオンとして表されます。この場合では:
\[ \rm CaCl_2\ (aq) ⟶ Ca^{2+}\ (aq) + 2Cl^−\ (aq)\\ 2AgNO_3\ (aq) ⟶ 2Ag^+\ (aq) + 2NO_3\ ^−\ (aq)\\ Ca(NO_3)_2\ (aq) ⟶ Ca^{2+}\ (aq) + 2NO_3\ ^−\ (aq) \]
これらの3つのイオン化合物とは異なり、AgClは、その物理的状態の表記法であるsによって示されるように、顕著な量で水に溶解することはありません。
すべての溶解イオンを明示的に表現すると、完全なイオン反応式になります。この特定の場合では、溶解したイオン化合物の式は、その解離イオンの式によって置き換えられます:
\[ \rm Ca^{2+}\ (aq) + 2Cl^−\ (aq) + 2Ag^+\ (aq) + 2NO_3\ ^−\ (aq) ⟶ Ca^{2+}\ (aq) + 2NO_3\ ^−\ (aq) + 2AgCl\ (s) \]
この式を調べると、2つの化学種(Ca²⁺(aq)とNO₃⁻(aq))が矢印の両側に同じ形で存在していることがわかります。これらの傍観イオン(電荷の中性を維持するために存在が必要とされるイオン)は、プロセスによって化学的にも物理的にも変化しないので、それらを反応式から除去して、正味イオン反応式と呼ばれる、より簡潔な表現を得ることができます:
\[ \rm Ca^{2+}\ (aq) + 2Cl^−\ (aq) + 2Ag^+\ (aq) + 2NO_3\ ^−\ (aq) ⟶ Ca^{2+}\ (aq) + 2NO_3\ ^−\ (aq) + 2AgCl\ (s)\\ 2Cl^−\ (aq) + 2Ag^+\ (aq) ⟶ 2AgCl\ (s) \]
係数として可能な限り小さい整数を使用するという慣習に従って、この式は次のように書かれます:
\[ \rm Cl^−\ (aq) + Ag^+\ (aq) ⟶ AgCl\ (s) \]
この正味イオン反応式は、固体の塩化銀が溶解した塩素イオンおよび銀(I)イオンから生成され得ること(それらのイオンの供給源に関係なく)を示しています。これらの分子反応式および完全なイオン反応式は、追加の情報、すなわち、Cl⁻およびAg⁺の供給源として使用されるイオン化合物を提供します。
例題4.2 分子反応式とイオン反応式
二酸化炭素を水酸化ナトリウム水溶液に溶解すると、混合物は反応して水溶性の炭酸ナトリウムと液体の水が得られます。このプロセスについて、バランスの取れた分子反応式、完全なイオン反応式、正味イオン反応式を書いてください。
解法
反応物と生成物の式を特定し、化学反応式の形で適切に配置することから始めます:
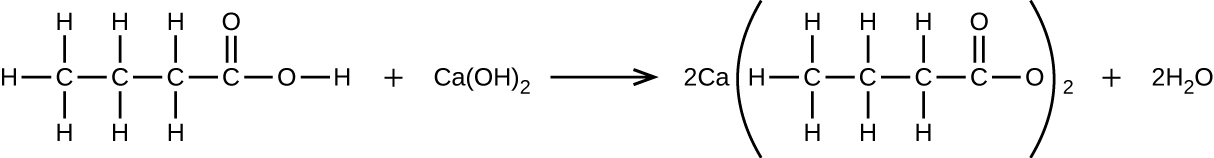
\[ \rm CO_2\ (aq) + NaOH\ (aq) ⟶ Na_2 CO_3\ (aq) + H_2 O(l)\ (アンバランス) \]
この場合、NaOHの係数を2に変えることによって容易にバランスを取ることができ、その結果、この反応についての分子反応式が得られます:
\[ \rm CO_2\ (aq) + 2NaOH\ (aq) ⟶ Na_2 CO_3\ (aq) + H_2 O\ (l) \]
2つの溶解したイオン化合物であるNaOHとNa₂CO₃は解離イオンとして表現することができ、それにより完全なイオン反応式を得ることができます:
\[ \rm CO_2\ (aq) + 2Na^+\ (aq) + 2OH^−\ (aq) ⟶ 2Na^+\ (aq) + CO_3\ ^{2−}\ (aq) + H_2 O\ (l) \]
最後に、傍観イオン(この場合はNa⁺(aq))を特定し、反応式のそれぞれの側からそのイオンを除去して、正味イオン反応式を作ります:
\[ \rm CO_2\ (aq) + 2Na^+\ (aq) + 2OH^−\ (aq) ⟶ 2Na^+\ (aq) + CO_3\ ^{2−}\ (aq) + H_2 O\ (l)\\ CO_2\ (aq) + 2OH^−\ (aq) ⟶ CO_3\ ^{2−}\ (aq) + H_2 O\ (l) \]
学習内容の確認
以下のバランスの取れていない式に示されるように、二原子塩素や水酸化ナトリウム(灰汁)は、塩水の電気分解によって二原子水素とともに大量に生産される汎用の化学物質です:
\[ \rm NaCl\ (aq) + H_2 O\ (l) \xrightarrow{電気}NaOH\ (aq) + H_2\ (g) + Cl_2\ (g) \]
このプロセスについて、バランスの取れた分子反応式、完全なイオン反応式、正味イオン反応式を書いてください。
解答:
\[ \rm 2NaCl(aq) + 2H_2 O(l) ⟶ 2NaOH(aq) + H_2 (g) + Cl_2 (g) (分子反応式)\\ 2Na^+ (aq) + 2Cl^− (aq) + 2H_2 O(l) ⟶ 2Na^+ (aq) + 2OH^− (aq) + H_2 (g) + Cl_2 (g) (完全なイオン反応式)\\ 2Cl^− (aq) + 2H_2 O(l) ⟶ 2OH^− (aq) + H_2 (g) + Cl_2 (g) (正味イオン反応式) \]
4.2 化学反応を分類する
この節が終わるまでに、あなたは次のことができるようになります:
•化学反応の3つの一般的なタイプ(沈殿、酸-塩基、酸化-還元)を定義する
•適切な記述または化学式に基づいて、化学反応をそれら3つのタイプのいずれかに分類する
•一般的な酸と塩基を識別する
•溶解度のルールを用いて一般的な無機化合物の溶解度を予測する
•化合物中の元素の酸化状態を計算する
人間は多様で複雑な方法によってお互いに相互作用していますが、私たちはこれらの相互作用を共通の行動パターンに従って分類しています。2人の人間が情報を交換している時には、私たちは「彼らがコミュニケーションをとっている」と言います。彼らが拳や足で攻撃を交わしている時には、私たちは「彼らがけんかをしている」と言います。これと同様に、化学物質の間の多種多様な相互作用に直面した際に、科学者たちは、反応性の共通パターンを識別することによって化学的相互作用を分類することが便利である(あるいは必要でさえある)ことを発見しました。この節では、最も一般的な化学反応の3つのタイプ、すなわち沈殿反応、酸-塩基反応、酸化-還元反応について紹介します。
沈殿反応と溶解度のルール
沈殿反応とは、溶解した物質が反応して1つ(またはそれ以上)の固体の生成物を形成する反応です。このタイプの反応の多くは、水溶液中のイオン化合物間のイオンの交換を伴うもので、二重置換反応、複分解反応、またはメタセシス反応と呼ばれることもあります。これらの反応は自然界では一般的であり、海洋でのサンゴ礁の形成や動物での腎臓結石の原因となっています。これらの反応は、多くの汎用化学物質や特殊化学物質の生産のために産業界で広く利用されています。沈殿反応はまた、金属イオンを同定するために使用されるスポット試験や、物質の組成を決定するための重量分析法など、多くの化学分析技術において中心的な役割を果たしています(本章の最後の節を参照)。
ある物質が水または任意の溶媒に溶解する程度は、溶解度として定量的に表現されます。溶解度は、特定の条件下で達成することのできる物質の最大濃度として定義されます。溶解度が比較的大きい物質は可溶性と言われます。溶液の濃度が物質の溶解度を超えるような状態になると、その物質は沈殿します。溶解度が比較的低い物質は不溶性と言われ、それらは溶液から容易に沈殿する物質です。これらの重要な概念についてのより詳しい情報は、後の溶液に関する章で与えられます。沈殿反応によって形成される固体の正体を予測するためには、多くのイオン化合物で観測されている溶解度のパターンを参考にするとよいでしょう(表4.1)。
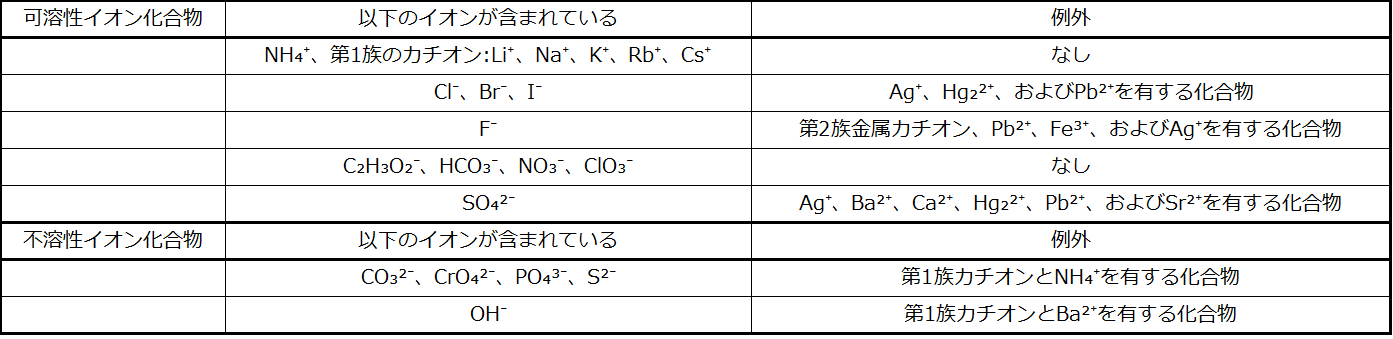
表4.1
沈殿についての鮮やかな例は、ヨウ化カリウムと硝酸鉛の溶液を混合して固体のヨウ化鉛を形成するときに観察されます:
\[ \rm 2KI\ (aq) + Pb(NO_3)_2\ (aq) ⟶ PbI_2\ (s) + 2KNO_3\ (aq) \]
この観察は、溶解度の指針と一致しています:関係するすべての化合物の中で唯一の不溶性化合物はヨウ化鉛(ヨウ化物塩の一般的な溶解度の例外の1つ)です。
この反応を表す正味イオン反応式は以下の通りです:
\[ \rm Pb^{2+}\ (aq) + 2I^−\ (aq) ⟶ PbI_2\ (s) \]
ヨウ化鉛は明るい黄色の固体で、以前はヨードイエローとして知られる芸術家の顔料として使用されていました(図4.4)。純粋なPbI₂結晶の性質は、X線およびガンマ線検出器の製造に有用です。

図4.4 | Pb²⁺とI⁻を含む溶液を混合したときに形成されるPbI₂の沈殿物。(credit: Der Kreole/Wikimedia Commons)
表4.1の溶解度の指針は、可溶性イオン化合物の溶液を混合したときに沈殿反応が起こるかどうかを予測するために使用することができます。それには、溶液中に存在するすべてのイオンを特定し、あり得るカチオン/アニオン対が不溶性化合物を生成するかどうかを検討するだけでよいです。たとえば、硝酸銀とフッ化ナトリウムの溶液を混合すると、Ag⁺、NO₃⁻、Na⁺、およびF⁻イオンを含む溶液が得られます。もともと溶液中に存在する2つのイオン化合物AgNO₃およびNaFの他に、2つの追加のイオン化合物NaNO₃とAgFがこのイオンの集まりから得られるかもしれません。溶解度の指針は、すべての硝酸塩が可溶性であることを示していますが、AgFはフッ化物塩の一般的な溶解度の例外の1つであることを示しています。したがって、以下の反応式によって記述されるように、沈殿反応が発生することが予測されます:
\[ \rm NaF\ (aq) + AgNO_3\ (aq) ⟶ AgF\ (s) + NaNO_3\ (aq)\ (分子反応式)\\ Ag^+\ (aq) + F^−\ (aq) ⟶ AgF\ (s)\ (正味イオン反応式) \]
例題4.3 沈殿反応を予測する
以下のイオン化合物の適度に濃縮された溶液を混合した結果を予測してください。沈殿が予想される場合は、その反応についてのバランスの取れた正味イオン反応式を書いてください。
(a)硫酸カリウムと硝酸バリウム
(b)塩化リチウムと酢酸銀
(c)硝酸鉛と炭酸アンモニウム
解法
(a)この組み合わせで考えられる2つの生成物はKNO₃とBaSO₄です。溶解度の指針では、BaSO₄は不溶性であることが示されているので、沈殿反応が起こると予想されます。前の節で詳述した方法で導出されたこの反応についての正味イオン反応式は、以下のとおりです:
\[ \rm Ba^{2+}\ (aq) + SO_4\ ^{2−}\ (aq) ⟶ BaSO_4\ (s) \]
(b)この組み合わせで考えられる2つの生成物はLiC₂H₃O₂とAgClです。溶解度の指針では、AgClは不溶性であることが示されているので、沈殿反応が起こると予想されます。前の節で詳述した方法で導出されたこの反応についての正味イオン反応式は、以下のとおりです:
\[ \rm Ag^+\ (aq) + Cl^−\ (aq) ⟶ AgCl\ (s) \]
(c)この組み合わせで考えられる2つの生成物はPbCO₃とNH₄NO₃です。溶解度の指針では、PbCO₃は不溶性であることが示されているので、沈殿反応が起こると予想されます。前の節で詳述した方法で導出されたこの反応についての正味イオン反応式は、以下のとおりです:
\[ \rm Pb^{2+}\ (aq) + CO_3\ ^{2−} (aq) ⟶ PbCO_3\ (s) \]
学習内容の確認
水の試料中のバリウムイオンBa²⁺を沈殿させるためには、以下のどの溶液を使用することができますか:塩化ナトリウム、水酸化ナトリウム、または硫酸ナトリウム。予想される沈殿物の式は何ですか?
解答:硫酸ナトリウム、BaSO₄
酸-塩基反応
酸-塩基反応とは、水素イオンH⁺がある化学種から別の化学種に移動する反応です。このような反応は、細胞や湖や海の中で起こる化学変換から、肥料や医薬品、そして社会に不可欠なその他の物質の産業規模での生産に至るまで、多くの自然界でのプロセスや技術的プロセスにおいて重要な役割を果たしています。したがって、酸-塩基化学という主題は徹底的に議論するに値するテーマであり、この教科書の後ろでは丸ごと1章をこのトピックに費やしています。
ここでの簡単な紹介という目的のために、私たちは水溶液中で起こる酸-塩基反応のうち、より一般的なタイプのみを検討していきます。この文脈では、酸とは水に溶解してヒドロニウムイオンH₃O⁺を生成する物質のことです。例として、ここに示されている式を考えてみましょう:
\[ \rm HCl\ (aq) + H_2 O\ (aq) ⟶ Cl^−\ (aq) + H_3 O^+\ (aq) \]
この反応式によって表されるプロセスから、塩化水素が酸であることが確認できます。水に溶けると、H⁺イオンがHCl分子からH₂O分子に移動する化学反応により、H₃O⁺イオンが生成されます(図4.5)。
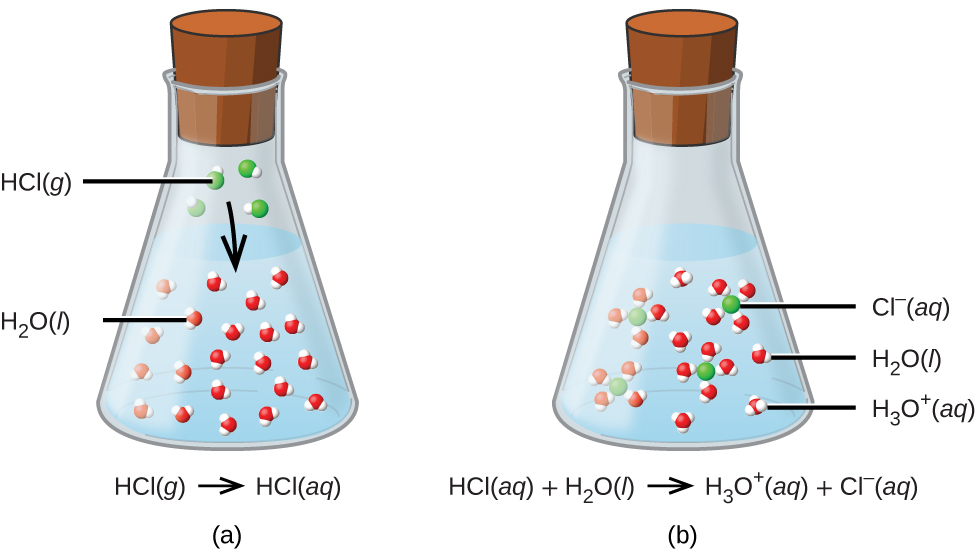
図4.5 | 塩化水素の気体が水に溶けると、(a)それは酸として反応して水分子に陽子を移動させ、(b)ヒドロニウムイオン(および溶媒和された塩化物イオン)が得られます。
HClの性質は、いま説明した水との反応が基本的に100%効率的であることを示しています:事実上、水に溶解したすべてのHCl分子はこの反応を起こします。このように完全に反応する酸は強酸と呼ばれ、HClは強酸として分類されるほんのいくつかの一般的な酸化合物の1つです(表4.2)。はるかに多くの化合物は弱酸として振る舞い、それらは部分的にしか水と反応せず、溶解した分子の大部分は元の形で残り、比較的少量のヒドロニウムイオンを生成します。弱酸は、自然界では一般的によく出会うものであり、柑橘類のピリッとした味、虫刺されのヒリヒリした感覚、体臭に関連付けられている不快な臭いの部分的な原因となっています。弱酸の代表例としては、食酢の主成分である酢酸があります:
\[ \rm CH_3 CO_2 H\ (aq) + H_2 O\ (l) ⇌ CH_3 CO_2\ ^−\ (aq) + H_3 O^+\ (aq) \]
典型的な条件下で水に溶解した場合、酢酸分子の約1%のみがイオン化された形(CH₃CO₂⁻)で存在しています(図4.6)。(上の反応式中で使用されている二重矢印は、このプロセスにおける部分反応という側面を表しています。この概念は、化学平衡の章で詳しく説明しています。)
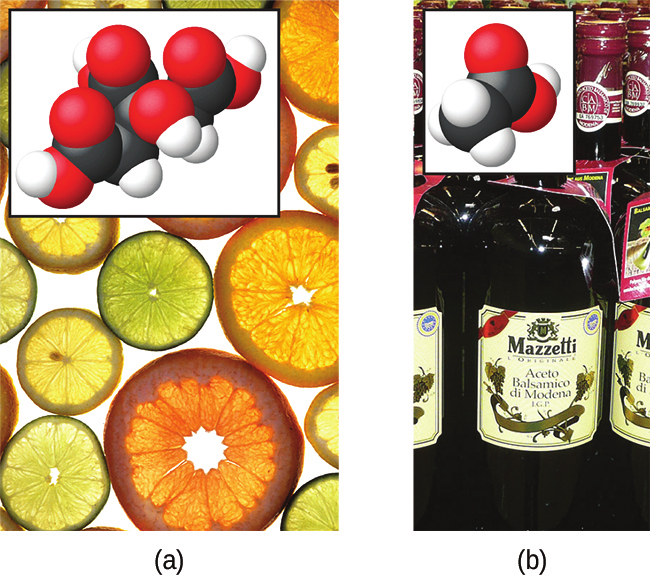
図4.6 | (a)オレンジ、レモン、グレープフルーツなどの果物には弱酸のクエン酸が含まれています。(b)酢には弱酸の酢酸が含まれています。(credit a: modification of work by Scott Bauer; credit b: modification of work by Brücke-Osteuropa/Wikimedia Commons)
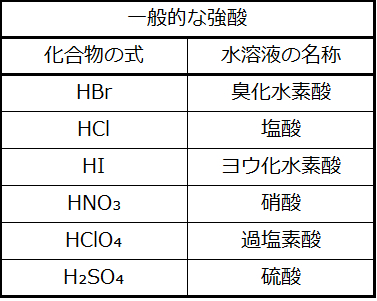
表4.2
塩基とは、水に溶解して水酸化物イオンOH⁻を生成する物質のことです。最も一般的な塩基は、アルカリ金属またはアルカリ土類金属カチオン(第1族と第2族)と水酸化物イオンとを結合させたイオン化合物(たとえばNaOHやCa(OH)₂)です。前述の酸性化合物とは異なり、これらの化合物は水と化学的に反応しません。その代わりに、それらは溶解・解離して水酸化物イオンを直接溶液中に放出します。たとえば、KOHとBa(OH)₂は水に溶解して完全に解離し、カチオン(それぞれ K⁺とBa²⁺)と水酸化物イオン(OH⁻)を生成します。これらの塩基は、水中で完全に解離する他の水酸化物とともに強塩基とみなされています。
例として、灰汁(水酸化ナトリウム)が水に溶解する場合を考えてみましょう:
\[ \rm NaOH\ (s) ⟶ Na^+\ (aq) + OH^−\ (aq) \]
この反応式は、水酸化ナトリウムが塩基であることを裏付けています。水に溶解すると、NaOHは解離してNa⁺イオンとOH⁻イオンを生成します。これは水酸化物イオンを含む他のイオン化合物にも当てはまります。典型的な条件下でイオン化合物が水に溶解するときの解離プロセスは本質的に完全なものであるため、NaOHと他のイオン性水酸化物はすべて強塩基に分類されます。
イオン性水酸化物とは異なり、一部の化合物は水分子と化学的に反応することによって溶解するときに水酸化物イオンを生成します。すべての場合、これらの化合物は部分的にしか反応しないため、弱塩基に分類されます。この種類の化合物は自然界にも豊富に存在し、さまざまな技術において重要な産品となっています。たとえば、弱塩基のアンモニアの世界的な生産量は、典型的には年間1億トンを優に超えており、農業用肥料、他の化合物の化学合成の原料、家庭用洗剤の有効成分として広く利用されています(図4.7)。アンモニアは、以下に示されるように、水に溶けると部分的に反応して水酸化物イオンを生成します:
\[ \rm NH_3\ (aq) + H_2 O\ (l) ⇌ NH_4\ ^+\ (aq) + OH^−\ (aq) \]
これは、定義上、酸-塩基反応であり、この場合、水分子からアンモニア分子へのH⁺イオンの移動を伴います。典型的な条件下では、溶解したアンモニアの約1%だけがNH₄⁺イオンとして存在しています。

図4.7 | アンモニアは弱塩基であり、さまざまな用途に使用されています。(a)純粋なアンモニアは農業用肥料として一般的に使用されています。(b)アンモニアの希釈液は効果的な家庭用洗剤です。(credit a: modification of work by National Resources Conservation Service; credit b: modification of work by pat00139)
中和反応とは、反応物が酸と塩基(ただし水ではない)であり、生成物がしばしば塩と水であるような特定のタイプの酸-塩基反応のことです。
\[ 酸 + 塩基 ⟶ 塩 + 水 \]
中和反応を説明するために、過剰な胃酸(HCl)に関連する症状を緩和するためにマグネシア乳(固体のMg(OH)₂の水性懸濁液)のような典型的な制酸剤を摂取した場合に何が起こるかを考えてみましょう:
\[ \rm Mg(OH)_2\ (s) + 2HCl\ (aq) ⟶ MgCl_2\ (aq) + 2H_2 O\ (l) \]
この反応では、水に加えて、塩である塩化マグネシウムが生成することに注意してください。
例題4.4 酸-塩基反応の反応式を書く
ここに記述されている酸-塩基反応について、バランスの取れた化学反応式を書いてください。
(a)弱酸の次亜塩素酸水素が水と反応する
(b)水酸化バリウムの溶液を硝酸の溶液で中和する
解法
(a)2つの反応物HOClとH₂Oが与えられています。物質は酸であると述べられているので、水との反応は、HOClからH₂OへのH⁺の移動を伴い、ヒドロニウムイオンH₃O⁺と次亜塩素酸イオンOCl⁻を生成します。
\[ \rm HOCl\ (aq) + H_2 O\ (l)⇌ OCl^-\ (aq) + H_3 O^+\ (aq) \]
この反応式では二重矢印が適切です。なぜなら、それはHOClが完全に反応していない弱酸であることを示しているからです。
(b)2つの反応物Ba(OH)₂とHNO₃が与えられています。これは中和反応なので、2つの生成物は水と塩(イオン性水酸化物のカチオン(Ba²⁺)と酸が水素イオンを移動させる際に生成されるアニオン(NO₃⁻)とからなります)となるでしょう。
\[ \rm Ba(OH)_2\ (aq) + 2HNO_3\ (aq) ⟶ Ba(NO_3 )_2\ (aq) + 2H_2 O\ (l) \]
学習内容の確認
任意のイオン性水酸化物で強酸の中和を表す正味イオン反応式を書いてください。(ヒント:強酸が水に溶解したときに生成されるイオンを考えてみてください。)
解答:H₃O⁺ (aq) + OH⁻ (aq) ⟶ 2H₂O(l)
日常生活の中の化学
胃の制酸剤
私たちの胃の中には、約0.03MのHClの溶液が含まれており、これは私たちが食べたものを消化するのを助けてくれます。胸焼けに関連付けられている焼けるような感覚は、胃の酸が胃の上部にある筋肉の弁を介して食道の下の方の範囲に漏れ出している結果です。食道の内膜は、胃の内膜のように胃酸の腐食の影響から守られてはいないため、結果として非常に痛みを伴うことがあります。私たちが胸焼けしているときは、制酸剤を飲んで食道内の余分な酸を還元すると気分が良くなります。あなたが推察する通り、制酸剤は塩基性です。最も一般的な制酸剤の1つは、炭酸カルシウムCaCO₃です。その反応は以下の通りです。
\[ \rm CaCO_3\ (s) + 2HCl\ (aq)⇌ CaCl_2\ (aq) + H_2 O\ (l) + CO_2\ (g) \]
これは、胃酸を中和するだけでなく、CO₂(g)を生成し、大きなげっぷになることがあります。
マグネシア乳は、難溶性の塩基の水酸化マグネシウムMg(OH)₂の懸濁液です。それは以下の反応に従って機能します:
\[ \rm Mg(OH)_2\ (s) ⇌ Mg^{2+}\ (aq) + 2OH^−\ (aq) \]
この平衡で生成された水酸化物イオンは、その後、胃酸からのヒドロニウムイオンと反応するように進行します:
\[ \rm H_3 O^+ + OH^− ⇌ 2H_2 O\ (l) \]
この反応では二酸化炭素は発生しませんが、マグネシウムを含む制酸剤は下剤効果を持つことがあります。いくつかの制酸剤は、有効成分として水酸化アルミニウム(Al(OH)₃)を持っています。水酸化アルミニウムは便秘の原因となる傾向があり、制酸剤の中には、水酸化アルミニウムと水酸化マグネシウムを併用して、2つの物質の副作用のバランスを取るものもあります。
日常生活の中の化学
化学の料理における側面
酸-塩基化学の例は、料理の世界では豊富にあります。一例としては、パンや菓子を焼くのに重曹、つまり重炭酸ナトリウムを使用することです。NaHCO₃は塩基です。生地の中でレモン汁、バターミルク、サワークリームなどの酸と反応すると、結果として生じる炭酸が分解されて二酸化炭素の気体の泡が発生し、生地が「膨らむ」のです。ベーキングパウダーは炭酸水素ナトリウムと1つかそれ以上の酸性塩の組み合わせで、2つの化学物質が生地の中で水と接触すると反応します。
多くの人は、調理した魚にレモン汁や酢(どちらも酸)をかけるのが好きです(図4.8)。魚の体内には揮発性のアミン(塩基)があることがわかっており、それらは酸によって中和されて不揮発性のアンモニウム塩が生成されます。これにより、魚の臭みが軽減され、私たちが好むような「酸味」が加わります。

図4.8 | レモンのクエン酸や酢の酢酸と、魚の身に含まれる塩基との間で中和反応が起こります。
ピクルス漬けにすることは、自然に作られた酸性環境を利用して野菜を保存する方法です。キュウリなどの野菜を漬物用の塩水が入った密閉ジャーに浸します。塩水の溶液は、有益な細菌の成長を促進し、有害な細菌の成長を抑制します。有益な細菌はキュウリに含まれるデンプンを食べて、発酵と呼ばれる過程で廃棄生成物として乳酸を生成します。乳酸は最終的に塩水の酸性度を高め、塩基性環境を必要とする有害な細菌を死滅させます。有害な細菌がキュウリを食べることがないので、それらは無防備な状態よりも長持ちします。ピクルス漬けの過程の副生成物である酸が野菜の味を酸っぱくするために、野菜の風味が変わります。
学習へのリンク
強酸と弱酸、強塩基と弱塩基の微視的な世界を探索してください(http://openstaxcollege.org/l/16AcidsBases)。
酸化-還元反応
地球の大気中には約20%の酸素分子O₂が含まれています。酸素は、好気性生物の代謝や世界を形作る多くの環境プロセスにおいて重要な役割を果たしている、化学的な反応性の高い気体です。酸化という用語は、もともとはO₂を含む化学反応を記述するために使用されていましたが、その意味は、酸化-還元反応として知られている広範で重要な反応分類を指すように進化してきました。このような反応の例をいくつか用いることで、この分類についての明確な展望を描くことができるでしょう。
以下のナトリウムと塩素が塩化ナトリウムを生成する反応のように、いくつかの酸化-還元反応では、イオン性の生成物を生成するために反応物の種の間で電子の移動を伴います:
\[ \rm 2Na\ (s) + Cl_2\ (g) ⟶ 2NaCl\ (s) \]
このプロセスをそれぞれの個々の反応物に関して見ること、すなわちそれぞれの反応物の経過を半反応と呼ばれる反応式の形で表現することが役に立ちます:
\[ \rm 2Na\ (s) ⟶ 2Na^+\ (s) + 2e^−\\ Cl_2\ (g) + 2e^− ⟶ 2Cl^−\ (s) \]
これらの反応式は、Na原子が電子を失い、Cl原子(Cl₂分子の中の)が電子を得ることを示しており、結果として得られるイオンの「s」の添え字は、それらが固体のイオン化合物の形で存在することを示しています。このような種類の酸化-還元反応では、電子の損失と獲得が、発生する相補的なプロセスを定義します:
\[ 酸化 = 電子の損失\\ 還元 = 電子の獲得 \]
この反応では、ナトリウムが酸化され、塩素が還元されます。より反応性の視点から見ると、ナトリウムは塩素に電子を与える(還元する)ため、還元剤(還元体)として機能します。同様に、塩素は、実質的にナトリウムから電子を除去する(酸化する)ため、酸化剤(酸化体)として機能します。
\[ 還元剤 = 酸化される種\\ 酸化剤 = 還元される種 \]
しかしながら、いくつかの酸化-還元プロセスは電子の移動を伴いません。たとえば、NaClを生成する反応に似た反応を考えてみましょう:
\[ \rm H_2\ (g) + Cl_2\ (g) ⟶ 2HCl\ (g) \]
この反応の生成物は共有結合化合物であり、明示的な意味での電子の移動は関与していません。この反応と以前の反応との類似性を明確にし、酸化-還元反応の定義の曖昧さをなくすために、酸化数と呼ばれる性質が定義されています。化合物中の元素の酸化数(酸化状態)とは、その化合物がイオン性の場合には、その原子が持つ電荷のことです。分子やイオンに含まれるそれぞれの元素に酸化数を割り当てるために、次のような指針が使われます。
元素の物質中の原子の酸化数は、ゼロです。
単原子イオンの酸化数は、イオンの電荷に等しいです。
一般的な非金属の酸化数は、通常は以下のように割り当てられます:
水素:非金属と結合した場合は+1、金属と結合した場合は-1
酸素:ほとんどの化合物で-2、時には-1(いわゆる過酸化物O₂²⁻)、非常にまれに-1/2(いわゆる超酸化物、O₂⁻)、Fと結合した場合には正の値(値は異なります)
ハロゲン:Fでは常に-1、他のハロゲンでは、酸素または他のハロゲンと結合した場合を除き-1(酸素または他のハロゲンと結合した場合は、正の酸化数で値は異なります)
分子または多原子イオン中のすべての原子の酸化数の合計は、分子またはイオンの電荷に等しいです。
注:電荷を報告するための適切な慣例は、最初に数字を書き、その後に符号をつけること(たとえば、2+)です。一方で、酸化数は逆の順序、すなわち記号の後に数字をつけるように書かれます(たとえば、+2)。この慣例は、これら2つの関連する性質の区別を強調することを目的としています。
例題4.5 酸化数を割り当てる
教科書のこの節の指針に従って、以下の種のすべての元素に酸化数を割り当ててください:
(a)H₂S
(b)SO₃²⁻
(c)Na₂SO₄
解法
(a)指針1によれば、Hの酸化数は+1です。 この酸化数と化合物の式を用いて、指針4によって硫黄の酸化数を計算することができます:
\[ {\rm H_2 Sの電荷} = 0 = (2 × +1) + (1 × x)\\ x = 0 − (2 × +1) = −2 \]
(b)指針3は、酸素の酸化数が-2であることを示唆しています。 この酸化数とイオンの式を用いて、指針4によって硫黄の酸化数を計算することができます:
\[ {\rm SO_3\ ^{2−} の電荷}= −2 = (3 × −2) + (1 × x)\\ x = −2 − (3 × −2) = +4 \]
(c)イオン化合物の場合は、カチオンとアニオンの酸化数を別々に割り当てると便利です。指針2によれば、ナトリウムの酸化数は+1です。 酸素の通常の酸化数(指針3によれば-2)を仮定すると、硫黄の酸化数は指針4の指示に従って計算されます:
\[ {\rm SO_4\ ^{2−} の電荷}= −2 = (4 × −2) + (1 × x)\\ x = −2 − (4 × −2) = +6 \]
学習内容の確認
以下の化合物またはイオンのそれぞれについて、指定された原子の元素に酸化状態を割り当ててください:
(a)KNO₃、(N)
(b)AlH₃、(Al)
(c)NH₄⁺、(N)
(d)H₂PO₄⁻、(P)
解答:(a)N:+5、(b)Al:+3、(c)N:−3、(d)P:+5
酸化数の概念を用いて、酸化-還元反応の包括的な定義が確立されています。酸化-還元反応とは、関与する1つかそれ以上の元素の酸化数が変化する反応のことです。(酸化-還元反応の大部分は2つかそれ以上の元素の酸化数の変化を伴いますが、このルールについてのいくつかの興味深い例外(例題4.6)が存在します。) それに応じて、この反応分類の相補的なプロセスについての定義は、以下に示されるように修正されています:
\[ 酸化 = 酸化数の増加\\ 還元 = 酸化数の減少 \]
このトピックの導入で使用した反応に戻ると、それらはどちらも酸化-還元プロセスとして特定できます。ナトリウムと塩素を反応させて塩化ナトリウムを生成する反応では、ナトリウムは酸化され(その酸化数はNa中での0からNaCl中での+1に増加)、塩素は還元されています(その酸化数はCl₂中での0からNaCl中での-1に減少)。水素分子と塩素分子の反応では、水素は酸化され(その酸化数はH₂中での0からHCl中での+1に増加)、塩素は還元されています(その酸化数はCl₂中での0からHCl中での-1に減少)。
酸化-還元反応にはいくつかの下位の種類があり、その中には燃焼反応が含まれます。燃焼反応は、還元剤(燃料とも呼ばれます)と酸化剤(しばしば酸素分子ですが、必ずそうであるわけではありません)が激しく反応して、炎の形で大量の熱(およびしばしば光)を発生させます。図4.1に描かれているような固体ロケット燃料反応は、燃焼プロセスです。固体アルミニウムが過塩素酸アンモニウムによって酸化される典型的な推進剤反応は、次のような反応式で表されます:
\[ \rm 10Al\ (s) + 6NH_4 ClO_4\ (s) ⟶ 4Al_2 O_3\ (s) + 2AlCl_3\ (s) + 12H_2 O\ (g) + 3N_2\ (g) \]
学習へのリンク
NASAが開発している新しいスペース・ローンチ・システムで使用するために計画されている、小規模なプロトタイプのハイブリッドロケットエンジンのテスト燃焼を示す短いビデオ(http://openstaxcollege.org/l/16hybridrocket)を見てください。3秒(緑色の炎)で燃焼する最初のエンジンは液体燃料と酸化剤の混合物を使用しており、4秒(黄色の炎)で燃焼する2番目のより強力なエンジンは固体混合物を使用しています。
単純置換反応(置換反応)とは、溶液中のイオンが金属元素の酸化によって置換される(取り換えられる)酸化-還元反応のことです。このタイプの反応の一般的な例の1つとしては、特定の金属の酸による酸化があります:
\[ \rm Zn\ (s) + 2HCl\ (aq)⟶ ZnCl_2\ (aq) + H_2\ (g) \]
また、金属元素は、他の金属塩の溶液によって酸化されることもあります。たとえば:
\[ \rm Cu\ (s) + 2AgNO_3\ (aq) ⟶ Cu(NO_3)_2\ (aq) + 2Ag\ (s) \]
この反応は、溶解した銀塩を含む溶液の中に銅線を入れることによって観察することができます。溶液中の銀イオンが銅線の表面で元素の銀に還元され、その結果生じたCu²⁺イオンが溶液の中に溶け出して特徴的な青色を呈します(図4.9)。

図4.9 | (a)銀(I)イオンを含む溶液の横に銅線が示されています。(b)溶解した銀イオンが銅イオンに置換されると、(c)灰色の銀の金属が銅線上に蓄積し、銅イオンが溶解するために溶液が青色になります。(credit: modification of work by Mark Ott)
例題4.6 酸化-還元反応を記述する
どの反応式が酸化-還元反応を表しているかを特定し、適切であれば反応の名前を述べてください。酸化-還元反応として特定された反応については、酸化剤と還元剤の名前を述べてください。
(a)ZnCO₃(s) ⟶ ZnO(s) + CO₂(g)
(b)2Ga(l) + 3Br₂(l) ⟶ 2GaBr₃(s)
(c)2H₂O₂(aq) ⟶ 2H₂O(l) + O₂(g)
(d)BaCl₂(aq) + K₂SO₄(aq) ⟶ BaSO₄(s) + 2KCl(aq)
(e)C₂H₄(g) + 3O₂(g) ⟶ 2CO₂(g) + 2H₂O(l)
解法
酸化-還元反応は、定義によって、1つかそれ以上の元素の酸化数が変化した場合に特定されます。
(a)すべての元素について酸化数が変化していないため、これは酸化-還元反応ではありません。
(b)これは酸化-還元反応です。ガリウムは酸化され、その酸化数はGa(l)中での0からGaBr₃(s)中での+3に増加しています。還元剤はGa(l)です。臭素は還元され、その酸化数はBr₂(l)中での0からGaBr₃(s)中での-1に減少しています。酸化剤はBr₂(l)です。
(c)これは酸化-還元反応です。これは同じ元素(酸素)が酸化と還元の両方を受ける反応(いわゆる不均化反応)であるため、特に興味深い反応です。酸素は酸化され、その酸化数はH₂O₂(aq)中での-1からO₂(g)中での0に増加しています。また酸素は還元もされ、その酸化数はH₂O₂(aq)中での-1からH₂O(l)中での-2に減少しています。不均化反応では、同じ物質が酸化剤と還元剤として機能します。
(d)すべての元素について酸化数が変化していないため、これは酸化-還元反応ではありません。
(e)これは酸化-還元反応(燃焼)です。炭素は酸化され、その酸化数はC₂H₄(g)中での-2からCO₂(g)中での+4に増加しています。還元剤(燃料)はC₂H₄(g)です。酸素は還元され、その酸化数はO₂(g)中での0からH₂O(l)中での-2に減少しています。酸化剤はO₂(g)です。
学習内容の確認
この反応式は、塩化スズ(II)の生成を記述しています:
\[ \rm Sn\ (s) + 2HCl\ (g) ⟶ SnCl_2\ (s) + H_2\ (g) \]
これは酸化-還元反応ですか?もしそうであれば、適切な場合にはより具体的な反応名を示し、酸化剤と還元剤を特定してください。
解答:はい、単純置換反応です。Sn(s)が還元剤、HCl(g)が酸化剤です。
半反応法によって酸化-還元反応のバランスを取る
水の媒体中で行われる酸化-還元反応では、しばしば水、ヒドロニウムイオン、水酸化物イオンが反応物または生成物として関与しています。これらの種は酸化されたり還元されたりするわけではありませんが、他の方法で化学的変化に参加しています(たとえば、オキシアニオンを形成するために必要な元素を提供することによって)。これらの反応を表す反応式は、検査によってバランスを取るのが非常に難しい場合があるため、このプロセスを支援するための体系的なアプローチが開発されてきました。非常に有用なアプローチの1つは、以下のステップを含む半反応の方法を使用することです:
酸化-還元プロセスを表す2つの半反応を書きます。
酸素と水素を除くすべての元素のバランスを取ります。
H₂O分子を加えることにより、酸素原子のバランスを取ります。
H⁺イオンを加えることにより、水素原子のバランスを取ります。
電子を加えることにより、電荷のバランスを取ります。
必要に応じて、それぞれの半反応の係数に可能な限り小さい整数を掛けて、それぞれの電子の数が等しくなるようにします。
バランスの取れた半反応を足し合わせ、反応式の両側に現れる種を除去することにより単純化します。
塩基性媒体(過剰な水酸化物イオン)中で起こる反応については、以下の追加のステップを行います。
OH⁻イオンを反応式の両側に H⁺イオンの数と等しい数で加えます。
H⁺イオンとOH⁻イオンの両方を含む反応式の側で、これらのイオンを結合して水分子を生成します。
余分な水分子を除去することにより反応式を単純化します。
最後に、原子の数と電荷の合計[1]の両方のバランスが取れていることを確認します。
例題4.7 酸性溶液中の酸化-還元反応のバランスを取る
酸性溶液中で重クロム酸イオンと鉄(II)が反応して鉄(III)とクロム(III)が生成するときのバランスの取れた反応式を書いてください。
\[ \rm Cr_2O_7\ ^{2−} + Fe^{2+} ⟶ Cr^{3+} + Fe^{3+} \]
解法
ステップ1. 2つの半反応を書きます。 それぞれの半反応には、1つの反応物と1つの生成物があり、1つの元素が共通して含まれています。
\[ \rm Fe^{2+} ⟶ Fe^{3+}\\ Cr_2O_7\ ^{2−} ⟶ Cr^{3+} \]
ステップ2.酸素と水素を除くすべての元素のバランスを取ります。鉄の半反応はすでにバランスが取れていますが、クロムの半反応では、左側に2つのCr原子、右側に1つのCr原子があります。反応式の右側の係数を2に変えると、Cr原子についてバランスが取れます。
\[ \rm Fe^{2+} ⟶ Fe^{3+}\\ Cr_2O_7\ ^{2−} ⟶ 2Cr^{3+} \]
ステップ3.H₂O分子を加えることにより、酸素原子のバランスを取ります。鉄の半反応には酸素原子は含まれていません。クロムの半反応では、左側に7個の酸素原子があり、右側には1個もないので、右側に7個の水分子を加えます。
\[ \rm Fe^{2+} ⟶ Fe^{3+}\\ Cr_2O_7\ ^{2−} ⟶ 2Cr^{3+} + 7H_2O \]
ステップ4.H⁺イオンを加えることにより、水素原子のバランスを取ります。鉄の半反応にはH原子は含まれていません。クロムの半反応では、右側に14個のH原子があり、左側には1個もないので、左側に14個の水素イオンを加えます。
\[ \rm Fe^{2+} ⟶ Fe^{3+}\\ Cr_2O_7\ ^{2−} + 14H^+ ⟶ 2Cr^{3+} + 7H_2O \]
ステップ5.電子を加えることにより、電荷のバランスを取ります。鉄の半反応では、左側が2+(1個のFe²⁺イオン)、右側が3+(1個のFe³⁺イオン)の合計電荷を持っています。右側に1個の電子を加えると、右側の電荷の合計は(3+)+(1-)=2+となり、電荷のバランスが取れます。 クロムの半反応では、左側の合計電荷は、(1×2-)+(14×1+)=12+となります(1個のCr₂O₇²⁻イオンと14個のH⁺イオン)。右側の合計電荷は、(2×3+)=6+となります(2個のCr³⁺イオン)。左側に6個の電子を加えると、左側の電荷の合計は(12+)+(6-)=6+となり、電荷のバランスが取れます。
\[ \rm Fe^{2+} ⟶ Fe^{3+} + e^−\\ Cr_2O_7\ ^{2−} + 14H^+ + 6e^− ⟶ 2Cr^{3+} + 7H_2O \]
ステップ6.一方の反応の電子の数がもう一方の反応の電子の数と等しくなるように、2つの半反応に数を掛けます。質量保存に一致するためには、そして、酸化-還元反応は電子の移動(生成や破壊ではなく)を伴うという考え方と一致するためには、鉄の半反応の係数に6を掛けなければなりません。
\[ \rm 6Fe^{2+} ⟶ 6Fe^{3+} + 6e^−\\ Cr_2O_7\ ^{2−} + 6e^− + 14H^+ ⟶ 2Cr^{3+} + 7H_2O \]
ステップ7.バランスの取れた半反応を足し合わせ、反応式の両側に現れる種を打ち消します。
\[ \rm 6Fe^{2+} + Cr_2O_7\ ^{2−} + 6e^− + 14H^+ ⟶ 6Fe^{3+} + 6e^− + 2Cr^{3+} + 7H_2O \]
6個の電子だけが余分な種です。反応式のそれぞれの側からそれらを取り除くと、このように単純化されたバランスの取れた反応式が得られます:
\[ \rm 6Fe^{2+} + Cr_2O_7\ ^{2−} + 14H^+ ⟶ 6Fe^{3+} + 2Cr^{3+} + 7H_2O \]
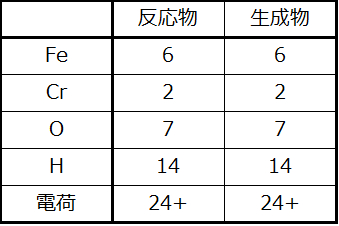
最後に原子と電荷のバランスをチェックし、反応式のバランスが取れていることを確認します。
学習内容の確認
塩基性の溶液中では、分子の塩素Cl₂が水酸化物イオンOH⁻と反応して、塩化物イオンCl⁻と塩素酸イオンClO₃⁻を生成します。ヒント:これは、元素の塩素が酸化も還元もされる不均化反応です。この反応について、バランスの取れた反応式を書いてください。
解答:3Cl₂(aq) + 6OH⁻(aq) ⟶ 5Cl⁻(aq) + ClO₃⁻(aq) + 3H₂O(l)
4.3 反応の化学量論
この節が終わるまでに、あなたは次のことができるようになります:
•化学反応に関連する化学量論の概念について説明する
•バランスの取れた化学反応式を用いて、反応物と生成物の量に関係する化学量論的な当量を導き出す
•質量、モル、溶液のモル濃度を含む化学量論的計算を実行する
バランスの取れた化学反応式は、非常に簡潔な形式で多くの情報を提供してくれます。化学式は、化学的変化に関与する反応物と生成物の同一性を提供し、反応を分類することを可能にします。係数は、これらの化学種の相対的な数を提供し、反応によって消費されたり生成されたりする物質の量の間の関係性を定量的に評価することを可能にします。これらの定量的な関係性は、反応の化学量論として知られています。化学量論(stoichiometry)は、ギリシャ語の単語stoicheion(「要素」を意味します)とmetron(「測定」を意味します)に由来する用語です。この節では、さまざまな化学量論的応用のためにバランスの取れた化学反応式を使用することについて探求していきます。
化学量論的な関係を使用するための一般的なアプローチは、人々が多くの普段の活動を行う方法の考え方に似ています。たとえば、食べ物の調理は、適切な比較を提供してくれます。8つのパンケーキを作るためのレシピでは、1カップのパンケーキミックス、3/4カップの牛乳、および1つの卵が必要です。このレシピに従ったホットケーキの調理を表す「反応式」は以下の通りです。
\[ 1カップのパンケーキミックス +\frac{3}{4}カップの牛乳 + 1つの卵 ⟶ 8枚のパンケーキ \]
もし大家族の朝食のために2ダースのパンケーキが必要な場合には、材料の量はレシピに記載されている量に応じて比例して増やさなければなりません。たとえば、24枚のパンケーキを作るのに必要な卵の数は以下の通りです。
\[ 24枚のパンケーキ ×\frac{1つの卵}{8枚のパンケーキ}= 3つの卵 \]
バランスの取れた化学反応式は、ある1つの反応物の所定の量と反応するために必要とされるもう1つの反応物の量を決定するためや、または、生成物の所定の量を得るために必要とされる反応物の量を決定するためなどに対して、ほとんど同じ方法で使用されています。バランスの取れた反応式の係数は、所望の量の計算を可能にする化学量論的な当量を導出するために使用されます。この考え方を説明するために、水素と窒素の反応によるアンモニアの生成を考えてみましょう:
\[ \rm N_2\ (g) + 3H_2\ (g) ⟶ 2NH_3\ (g) \]
この反応式は、アンモニア分子が水素分子から2:3の比率で生成されることを示しており、化学量論的な当量は任意の量(数)単位を用いて導出することができます:
\[ \rm \frac{2 NH_3分子}{3 H_2分子}\ または\ \frac{2ダースのNH_3分子}{3ダースのH_2分子}\ または\ \frac{2 molのNH_3 分子}{3 molのH_2 分子} \]
これらの化学量論的な当量は、与えられた数の水素分子から生成されるアンモニア分子の数、または与えられた数のアンモニア分子を生成するのに必要な水素分子の数を計算するために使用することができます。同様の当量は、化学反応式のどのような物質のペアに対しても導出することができます。
例題4.8 反応に必要な反応物のモル数
以下の反応式(図4.10参照)に従って、0.429molのAlと反応するのに必要とされるI₂のモル数は何ですか?
\[ \rm 2Al + 3I_2 ⟶ 2AlI_3 \]

図4.10 | アルミニウムとヨウ素が反応してヨウ化アルミニウムが生成されます。反応の熱で固体のヨウ素の一部が紫色の蒸気として蒸発しています。(credit: modification of work by Mark Ott)
解法
バランスの取れた化学反応式を参照すると、対象となる2つの物質の化学量論的な当量は(3 molのI₂)/(2 molのAl)となります。ヨウ素のモル量は、与えられたアルミニウムのモル量にこの当量を掛けることにより導出できます:

\[ \rm mol\ I_2 = 0.429\ mol\ Al ×\frac{3\ mol\ I_2}{2\ mol\ Al}= 0.644\ mol\ I_2 \]
学習内容の確認
3Ca(OH)₂+ 2H₃PO₄ ⟶ Ca₃(PO₄)₂+ 6H₂Oの反応式に従ってCa₃(PO₄)₂を生成するために、1.36molのH₃PO₄と反応させるのに必要とされるCa(OH)₂のモル数は何ですか?
解答:2.04 mol
例題4.9 反応によって生成される生成物の分子の数
この反応式に従って0.75 molのプロパンを燃焼させると、何個の二酸化炭素分子が生成されるでしょうか?
\[ \rm C_3H_8 + 5O_2 ⟶ 3CO_2 + 4H_2O \]
解法
ここでのアプローチは例題4.8と同じですが、分子のモル数ではなく絶対的な数が要求されています。これは単純にモル数から数への変換因子、つまりアボガドロ数を使用することが必要となるでしょう。
バランスの取れた反応式は、プロパンから二酸化炭素が3:1の比率で生成されることを示しています:
\[ \rm \frac{3\ mol\ CO_2}{1\ molC_3 H_8} \]
この化学量論的な当量、与えられたプロパンのモル量、およびアボガドロ数を用いて、

\[ \rm 0.75\ mol\ C_3H_8 ×\frac{3\ mol\ CO_2}{1\ mol\ C_3H_8}×\frac{6.022 × 10^{23}\ CO_2分子}{mol\ CO_2}= 1.4 × 10^{24}\ CO_2分子 \]
学習内容の確認
以下の反応式に従って4.0molのCa(OH)₂を反応させると、何個のNH₃分子が生成されるでしょうか:
\[ \rm (NH_4 )_2 SO_4 + Ca(OH)_2 ⟶ 2NH_3 + CaSO_4 + 2H_2 O \]
解答:4.8 × 10²⁴個のNH₃分子
これらの例は、既知の化学量論の化学反応に関与する物質の量を簡単に関連付けることができることを示しています。しかしながら、原子や分子の数を直接測定するのは簡単なことではありません。私たちは、化学量論を実際に適用するには、より容易に測定することのできる質量という性質を利用する必要があります。
例題4.10 反応物と生成物の質量を関連付ける
以下の反応によって制酸剤のマグネシア乳[水酸化マグネシウムMg(OH)₂]を16g生成するのに必要な水酸化ナトリウムNaOHの質量は何ですか?
\[ \rm MgCl_2\ (aq) + 2NaOH\ (aq) ⟶ Mg(OH)_2\ (s) + 2NaCl\ (aq) \]
解法
例題4.8と例題4.9で使用したアプローチをここでも同様に使用します。つまり、私たちはバランスの取れた化学反応式から適切な化学量論的な当量を導出し、それを使用して目的の2つの物質の量を関連付けなければなりません。しかしながら、この場合、質量(モル量ではなく)が与えられており、また、質量を求めなければならないので、前の章で学んだような追加のステップが必要です。必要な計算の概要はこのフローチャートに示されています:
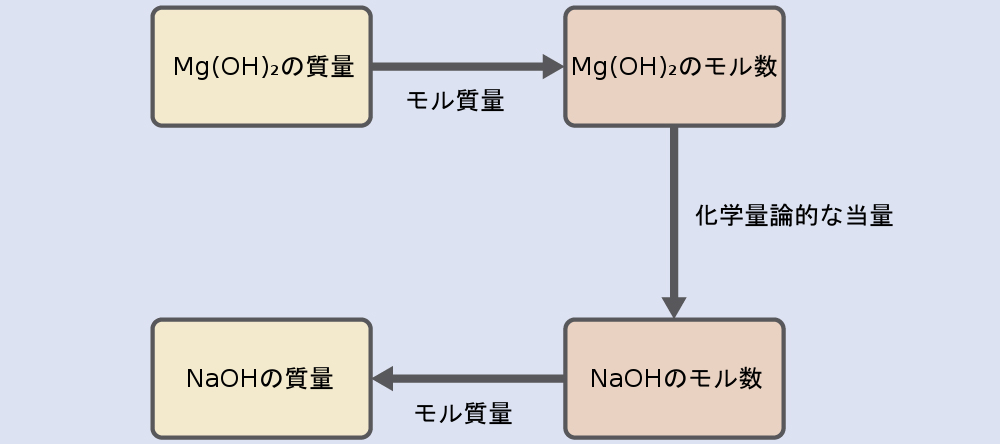
\[ \rm 16\ g\ Mg(OH)_2 ×\frac{1\ mol\ Mg(OH)_2}{58.3\ g\ Mg(OH)_2}×\frac{2\ mol\ NaOH}{1\ mol\ Mg(OH)_2}×\frac{40.0\ g\ NaOH}{mol\ NaOH}= 22\ g\ NaOH \]
学習内容の確認
29.0 g のガリウム金属から生成することのできる酸化ガリウム(Ga₂O₃)の質量は何ですか?この反応の反応式は、4Ga + 3O₂ ⟶ 2Ga₂O₃です。
解答:39.0 g
例題4.11 反応物の質量を関連付ける
ガソリンの主成分の1つであるオクタン(C₈H₁₈)702gの燃焼では、空気中の酸素気体O₂はどれだけの質量が消費されますか?
\[ \rm 2C_8 H_{18} + 25O_2 ⟶ 16CO_2 + 18H_2 O \]
解法
ここで必要とされるアプローチは例題4.10と同じですが、与えられた質量と求める質量がどちらも反応する種のものであるという点が異なっています。
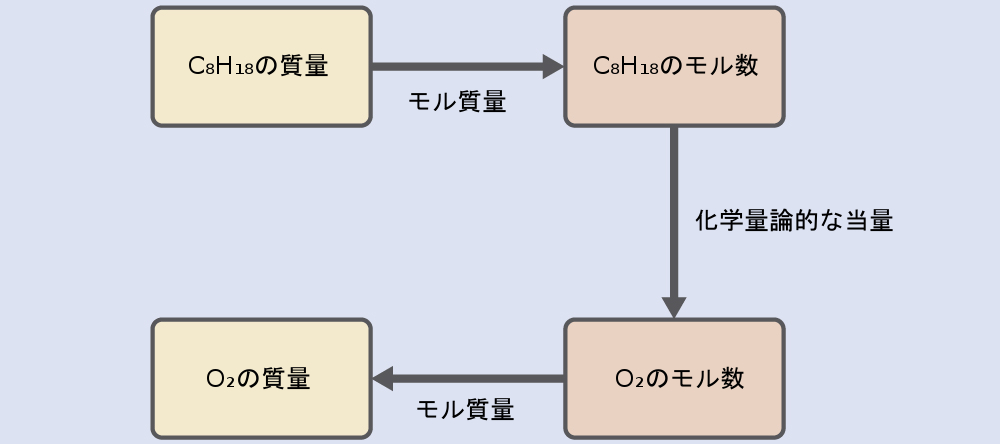
\[ \rm 702\ g\ C_8 H_{18} ×\frac{1\ mol\ C_8 H_{18}}{114.23\ g\ C_8 H_{18}}×\frac{25\ mol\ O_2}{2\ mol\ C_8 H_{18}}×\frac{32.00\ g\ O_2}{mol\ O_2}= 2.46 × 10^3\ g\ O_2 \]
学習内容の確認
反応式Fe₂O₃ + 3CO ⟶ 2Fe + 3CO₂に従うと、25.13gのFe₂O₃と反応するのにどれだけの質量のCOが必要でしょうか?
解答:13.22 g
これらの例題は、反応の化学量論計算のほんの数例を示しているだけです。計算の最初と最後のステップには、与えられる特定の量、および求める特定の量(体積、溶液濃度など)に応じて、多くのバリエーションがあります。その詳細にかかわらず、これらすべての計算は共通した本質的な要素を共有しています:それは、バランスの取れた化学反応式から導出された化学量論的な当量の使用です。図4.11は、多くの反応の化学量論的計算に関連するさまざまな計算ステップの一般的な概要を示しています。
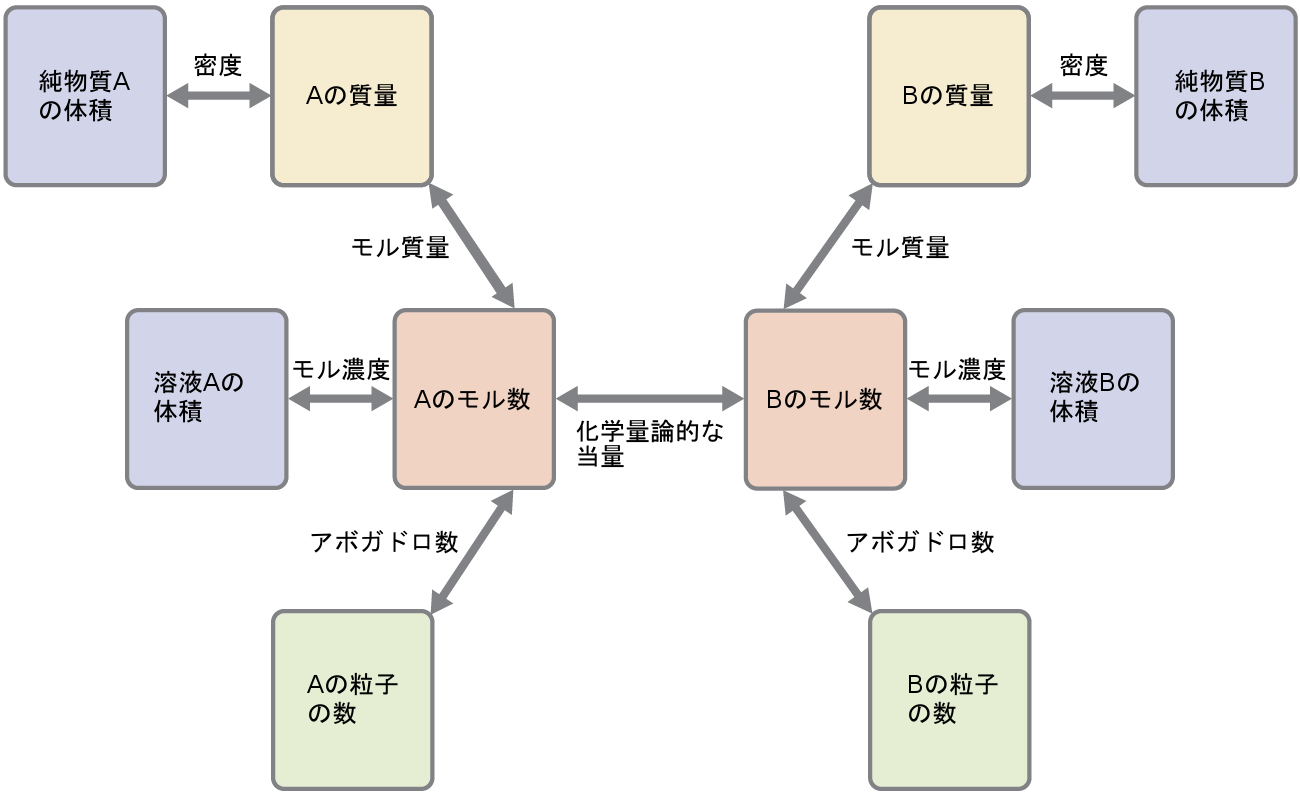
図4.11 | このフローチャートは、ほとんどの反応の化学量論計算に関わるさまざまな計算ステップを示しています。
日常生活の中の化学
エアバッグ
エアバッグ(図4.12)は、1990年代以降、ほとんどの自動車に備え付けられている安全装備です。エアバッグを効果的に作動させるためには、車両が衝突した際に適切な量(体積)の気体で迅速に膨張させる必要があります。多くの自動車用エアバッグシステムでは、爆発的な化学反応を通じてこの要件を満たしています。一般的にはアジ化ナトリウム (NaN₃) の分解が選択されています。車両のセンサーが衝突を検知すると、注意深く測定された量のNaN₃に電流を流して分解を開始します:
\[ \rm 2NaN_3\ (s) ⟶ 3N_2\ (g) + 2Na\ (s) \]
この反応は非常に急速で、気体状の窒素を発生させ、典型的なエアバッグをほんのわずかな時間 (およそ0.03~0.1秒) で展開して完全に膨らませることができます。多くの工学的な考慮事項の中でも、使用されるアジ化ナトリウムの量は、エアバッグを完全に膨らませ、適切な機能を確保するのに十分な窒素気体を発生させるのに適切な量でなければなりません。たとえば、少量(およそ100g)のNaN₃で約50LのN₂を発生させることができます。

図4.12 | エアバッグは衝突時に展開し、乗客の深刻な怪我を最小限に抑えます。(credit: Jon Seidman)
4.4 反応の収率
この節が終わるまでに、あなたは次のことができるようになります:
•理論収率と限定反応物/限定試薬の概念を説明する
•指定された条件下での反応の理論収量を導出する
•反応のパーセント収率を計算する
バランスの取れた化学反応式で表される反応物と生成物の相対的な量は、しばしば化学量論的な量と呼ばれます。前の節のすべての例題では、反応物の化学量論的な量が関係していました。たとえば、所定の量の反応物から生成される生成物の量を計算するとき、必要な他の反応物は化学量論的な量(またはそれ以上)で利用できるものと仮定されていました。この節では、反応物が化学量論的な量では存在しない、より現実的な状況を考慮します。
限定反応物
もう1つの食べ物のたとえ話として、グリルドチーズのサンドイッチを作ることを考えてみましょう(図4.13):
\[ 1 スライスのチーズ + 2 スライスのパン ⟶ 1 つのサンドイッチ \]
このレシピのためのサンドイッチ材料の化学量論的な量は、2:1の比率でのパンのスライスとチーズのスライスです。28スライスのパンと11スライスのチーズがあれば、提供されたレシピに従って11個のサンドイッチを用意することができます。このとき、与えられたすべてのチーズは利用され、6スライスのパンが残っています。このシナリオでは、用意されたサンドイッチの数はチーズのスライス数によって限定されており、パンのスライスは過剰に与えられています。
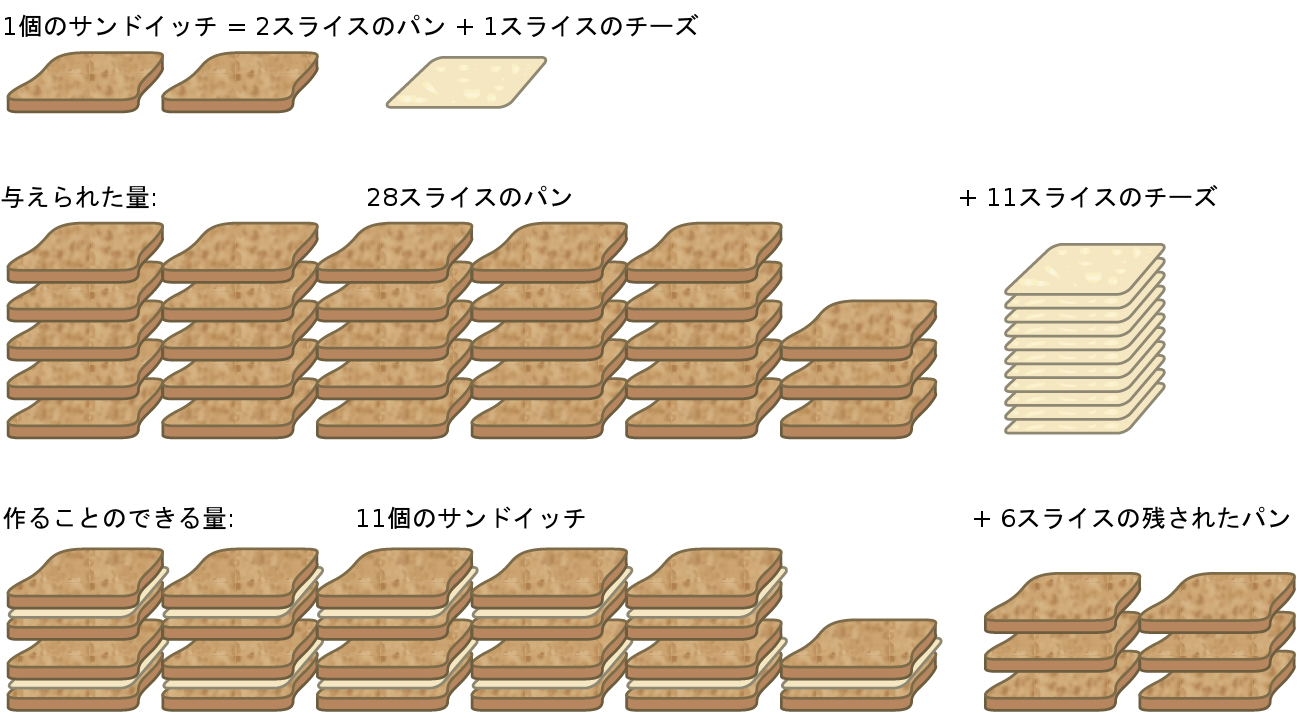
図4.13 | サンドイッチの作り方は、限定反応物と過剰反応物の概念を説明することができます。
それでは、この概念を化学プロセス、ここでは水素と塩素を反応させて塩化水素を生成する反応に関連させて考えてみましょう:
\[ \rm H_2\ (g) + Cl_2\ (g) ⟶ 2HCl\ (g) \]
バランスの取れた反応式は、水素と塩素が1:1の化学量論的な比率で反応することを示しています。もしこれらの反応物が他の量で与えられる場合、反応物の1つはほぼ常に完全に消費され、生成される生成物の量を限定します。この物質が限定反応物であり、他の物質が過剰反応物です。所与の状況で限定反応物と過剰反応物を特定するには、与えられたそれぞれの反応物のモル量を計算し、それらをバランスの取れた化学反応式で表される化学量論的な量と比較する必要があります。たとえば、3モルのH₂と2モルのCl₂を結合させることを想像してみてください。これは、反応のために存在する水素と塩素が3:2(または1.5:1) の比率であることを表しており、これは化学量論的な比率1:1よりも大きいです。したがって、水素が過剰に存在し、塩素が限定反応物となります。与えられたすべての塩素(2 mol)を反応させると、与えられた3 molの水素のうち2 molが消費され、1 molの水素が未反応のままになります。
限定反応物を特定するための代わりのアプローチは、それぞれの反応物の完全な反応の結果として予想される生成物の量を比較することです。それぞれの反応物の量は、反応の化学量論あたりに形成されるであろう生成物の量を個別に計算するために使用されます。得られる生成物の量が少ない反応物が限定反応物となります。前段落の例では、水素を完全に反応させると以下のものが得られるでしょう。
\[ \rm mol\ 生成されるHCl = 3\ mol\ H_2 ×\frac{2\ mol\ HCl}{1\ mol\ H_2}= 6\ mol\ HCl \]
与えられた塩素を完全に反応させると、以下のものを生成するでしょう。
\[ \rm mol\ 生成されるHCl = 2\ mol\ Cl_2 ×\frac{2\ mol\ HCl}{1\ mol\ Cl_2}= 4\ mol\ HCl \]
4モルのHClが生成されると、塩素は完全に消費されます。6モルのHClを生成するのに十分な水素が与えられているので、この反応が完了するときには未反応の水素が残っています。したがって、塩素が限定反応物となり、水素が過剰反応物となります(図4.14)。
図4.14 | H₂とCl₂が非化学量論的な量で結合した場合、これらの反応物のいずれかが生成可能なHClの量を限定します。この図は、水素が過剰に存在し、塩素が限定反応物であるような反応を示しています。
学習へのリンク
限定反応物と過剰反応物の概念を説明したインタラクティブなシミュレーション(http://openstaxcollege.org/l/16reactantprod)を見てください。
例題4.12 限定反応物を特定する
窒化ケイ素は、ジェットエンジンのタービン翼の部品として使用される非常に硬くて、高温に耐性のあるセラミックです。それは、以下の反応式に従って生成されます:
\[ \rm 3Si\ (s) + 2N_2\ (g) ⟶ Si_3 N_4\ (s) \]
2.00gのSiと1.50gのN₂が反応するときの限定反応物はどちらですか?
解法
与えられた反応物のモル量を計算し、これらの量をバランスの取れた反応式と比較して、限定反応物を特定します。
\[ \rm mol\ Si = 2.00\ g\ Si ×\frac{1\ mol\ Si}{28.09\ g\ Si}= 0.0712\ mol\ Si\\ mol\ N_2 = 1.50\ g\ N_2 ×\frac{1\ mol\ N_2}{28.02\ g\ N_2}= 0.0535\ mol\ N_2 \]
与えられたSi:N₂のモル比は:
\[ \rm \frac{0.0712\ mol\ Si}{0.0535\ mol\ N_2}=\frac{1.33\ mol\ Si}{1\ mol\ N_2} \]
化学量論的なSi:N₂の比は:
\[ \rm \frac{3\ mol\ Si}{2\ mol\ N_2}=\frac{1.5\ mol\ Si}{1\ mol\ N_2} \]
これらの比を比較すると、Siが化学量論的な量よりも少ない量で与えられており、そのため限定反応物であることが示されます。
代わりのやり方としては、与えらえたそれぞれの反応物の完全な反応の結果として期待される生成物の量を計算します。0.0712モルのケイ素からは以下のものが得られるでしょう。
\[ \rm mol\ 生成されるSi_3 N_4 = 0.0712\ mol\ Si×\frac{1\ mol\ Si_3 N_4}{3\ mol\ Si}= 0.0237\ mol\ Si_3 N_4 \]
一方で、0.0535モルの窒素からは以下のものが生成するでしょう。
\[ \rm mol\ 生成されるSi_3 N_4 = 0.0535\ mol\ N_2 ×\frac{1\ mol\ Si_3 N_4}{2\ mol\ N_2}= 0.0268\ mol\ Si_3 N_4 \]
ケイ素は生成物の量が少ないので、それが限定反応物となります。
学習内容の確認
5.00 gのH₂と10.0 gのO₂が反応して水を生成するときの限定反応物はどちらですか?
解答:O₂
パーセント収率
適切なバランスの取れた化学反応式の化学量論に従って計算された、特定の条件下での反応によって生成されることのある生成物の量は、反応の理論収量と呼ばれています。実際には、得られる生成物の量は実際の収量と呼ばれ、多くの理由から理論収量よりも低いことが多いです。いくつかの反応は本質的に非効率的であり、副反応を伴って他の生成物を生成します。その他の反応は、本質的に不完全です(この章で先に議論した弱酸と弱塩基の部分反応を考えてみてください)。いくつかの生成物は、多少の損失を伴わずに回収することが困難であり、そのため、完全でない回収によって実際の収量が低下します。反応の理論収量がどの程度達成されているかは、一般的にパーセント収率で表されます:
\[ パーセント収率 =\frac{実際の収量}{理論収量}× 100% \]
実際の収量と理論収量は、質量またはモル量(または他の適切な性質、たとえば、生成物が気体の場合は体積)として表すことができます。両方の収量が同じ単位を用いて表現されている限り、パーセント収率を計算する際には、これらの単位は打ち消されるでしょう。
例題4.13 パーセント収率の計算
1.274 gの硫酸銅と過剰な金属亜鉛を反応させると、以下の反応式に従って0.392 gの金属銅が得られました:
\[ \rm CuSO_4\ (aq) + Zn\ (s) ⟶ Cu\ (s) + ZnSO_4\ (aq) \]
このパーセント収率は何ですか?
解法
与えられた情報によって、硫酸銅が限定反応物として特定されます。理論収量は、ここに示すように、前の節で説明したアプローチによって見出すことができます:
\[ \rm 1.274\ g\ CuSO_4 ×\frac{1\ mol\ CuSO_4}{159.62\ g\ CuSO_4}×\frac{1\ mol\ Cu}{1\ mol\ CuSO_4}×\frac{63.55\ g\ Cu}{1\ mol\ Cu}= 0.5072\ g\ Cu \]
この理論収量と実際の収量として与えられた値を使用すると、パーセント収率は以下のように計算されます。
\[ \rm パーセント収率 = \left(\frac{実際の収量}{理論収量}\right) × 100\\ パーセント収率 = \left(\frac{0.392\ g\ Cu}{0.5072\ g\ Cu}\right) × 100= 77.3% \]
学習内容の確認
32.9gのCCl₄と過剰なHFから気体のフロンCF₂Cl₂を12.5 g生成する反応のパーセント収率は何ですか?
\[ \rm CCl_4 + 2HF ⟶ CF_2 Cl_2 + 2HCl \]
解答:48.3%
さまざまな科学のつながり
グリーンケミストリーとアトムエコノミー
環境に有害な物質の使用や廃棄物の発生を最小限に抑えるような化学製品やプロセスを意図的に設計することは、グリーンケミストリーとして知られています。グリーンケミストリーは、科学技術の多くの分野に適用されている賢明なアプローチであり、その実践は「グリーンケミストリーの12の原則」として知られるガイドラインにまとめられています(詳細についてはこのウェブサイト(http://openstaxcollege.org/l/16greenchem)を参照)。この12の原則のうちの1つは、化学製品を合成するプロセスの効率を最大化することを特に目的としたものです。プロセスのアトムエコノミーとは、この効率性の尺度であり、使用されるすべての反応物の質量に対する合成の最終生成物の質量の割合として定義されています:
\[ アトムエコノミー =\frac{生成物の質量}{反応物の質量}× 100% \]
アトムエコノミーの定義は、一見するとパーセント収率の定義と非常に似ていますが、この性質はさまざまな化学プロセスの理論的な効率の違いを表していることに注意してください。一方、ある化学プロセスのパーセント収率は、実際に得られる生成物の収量と、化学量論で予測される最大の収量とを比較することで、プロセスの効率を評価するものです。
一般的な非処方薬の鎮痛剤であるイブプロフェンの合成は、グリーンケミストリーのアプローチの成功をうまく示しています(図4.15)。1960年代初頭に初めて販売されたイブプロフェンは、6段階の合成法を用いて製造され、1モル(206 g)のイブプロフェンを生成するのに 514gの反応物を必要としていました(40%のアトムエコノミー)。1990年代に、BHCカンパニー(現BASFコーポレーション)によって代替プロセスが開発されました。そのプロセスでは3つの段階しか必要とせず、アトムエコノミーは元のプロセスの約2倍の80%となっています。BHCプロセスは、化学廃棄物の生成を大幅に少なくし、より危険性が少なくリサイクル可能な材料を使用し、製造業者の(および、結果として消費者の)コストを大きく削減しています。BHCプロセスの環境へのポジティブな影響が認められ、同社は1997年に環境保護庁の「Greener Synthetic Pathways Award(よりグリーンな合成経路賞)」を受賞しました。
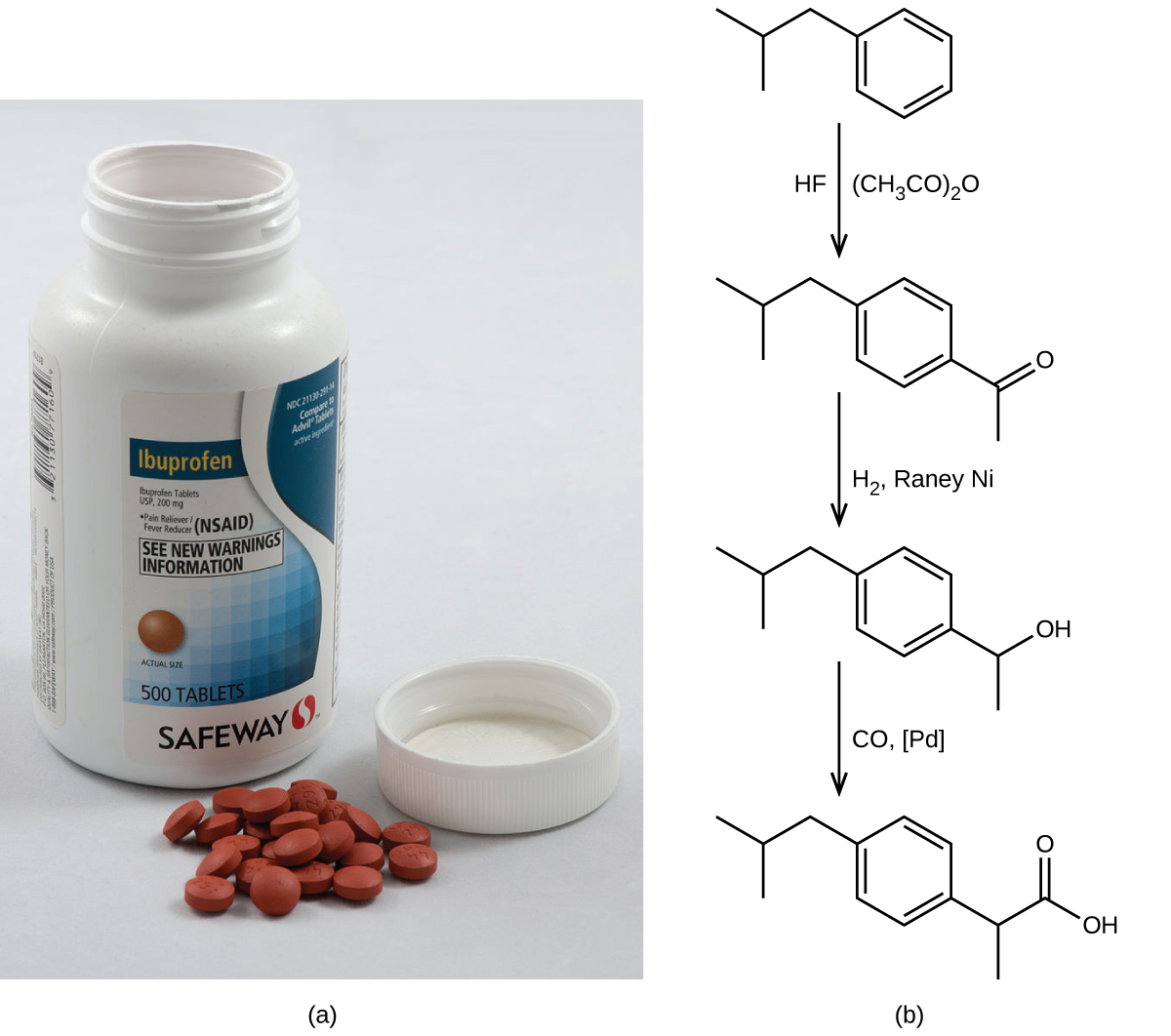
図4.15 | (a)イブプロフェンは、通常は200mg錠として販売されている一般的な非処方薬の鎮痛剤です。(b)イブプロフェンを合成するためのBHCプロセスは、わずか3つの段階を必要とし、驚くほどのアトムエコノミーを示しています。(credit a: modification of work by Derrick Coetzee)
4.5 定量的な化学分析
この節が終わるまでに、あなたは次のことができるようになります:
•滴定法と重量分析法の基本的な側面を記述する
•典型的な滴定データおよび重量分析データを用いて、化学量論的な計算を行う
18世紀には、酢の試料の強度(実際には濃度)は、炭酸カリウムK₂CO₃の量を記録することによって決定されていました。炭酸カリウムは、一度に少量づつ、発泡が止まるまで添加されました。発泡が止まる時点に至るまでに添加した炭酸カリウムの量が多いほど、酢の濃度が高かったです。
このプロセスで発生した泡立ちは、酢の匂いや味の主な原因となる化合物である酢酸CH₃CO₂Hとの反応によるものであることがわかっています。酢酸は以下の反応式に従って炭酸カリウムと反応します:
\[ \rm 2CH_3 CO_2 H\ (aq) + K_2 CO_3\ (s) ⟶ 2CH_3 CO_2 K\ (aq) + CO_2\ (g) + H_2 O\ (l) \]
この発泡は、CO₂の生成によるものです。
炭酸カリウムを用いた酢の試験は、定量分析の一種です。定量分析とは、試料中の物質の量や濃度を決定するものです。酢の分析では、既知の量の溶液中に存在する溶質と結合した反応物の量から溶質(酢酸)の濃度を決定します。その他の化学分析では、結果として得られる生成物の量を測定することにより、試料中に存在する物質の量を決定します。
滴定法
上で記述された酢の強度を測定するためのアプローチは、滴定分析として知られている分析技術の初期のバージョンでした。典型的な滴定分析では、ビュレット(図4.16)を使用して、濃度を測定する物質(被分析物)を含む試料溶液に、既知の濃度の何らかの物質を含む溶液(滴定剤)を徐々に添加します。滴定剤と被分析物は化学量論的に既知の化学反応を起こします。そのため、被分析物と完全に反応するために必要な滴定溶液の体積(滴定の当量点)を測定することで、被分析物の濃度を計算することができます。滴定の当量点は、反応が完了したときに試料溶液の外観が明らかに変化するならば、目視で検出することがあります。古典的な酢の分析において泡の形成が止まったことはその一例ですが、より一般的には、滴定の当量点、またはその非常に近くの点で色の変化を与えるために、指示薬と呼ばれる特殊な染料を試料溶液に添加します。当量点は、滴定中に予測可能な方法で変化する溶液の性質を測定することによって検出することもできます。滴定の当量点を検出するためにどのアプローチをとるかにかかわらず、実際に測定された滴定剤の体積は終点と呼ばれます。適切に設計された滴定法であれば、通常、当量点と終点の差は無視できるほどであることが確認されています。どのようなタイプの化学反応でも滴定分析の基礎として務まるかもしれませんが、本章で説明した3つの反応(沈殿、酸-塩基、酸化-還元)が最も一般的です。滴定分析に関する追加の詳細は酸-塩基平衡の章で与えられています。

図4.16 | (a)学生が滴定分析の準備のためにビュレットを充填しています。(b)典型的なビュレットでは、0.01 mL単位での体積測定が可能です。(credit a: modification of work by Mark Blaser and Matt Evans; credit b: modification of work by Mark Blaser and Matt Evans)
例題4.14 滴定分析
50.00 mLのHCl水溶液の試料の滴定において、0.250 MのNaOH滴定剤35.23 mLの添加によって終点に到達しました。滴定反応は以下の通りです:
\[ \rm HCl\ (aq) + NaOH\ (aq) ⟶ NaCl\ (aq) + H_2 O\ (l) \]
HClのモル濃度は何ですか?
解法
すべての反応の化学量論計算と同様に、重要な問題は、バランスの取れた化学反応式に描かれているような、関心のある化学種のモル量の間の関係です。この章の前の節で説明したアプローチを踏襲しますが、与えられた反応物の量と求める反応物の量が溶液の濃度で表されているため、追加の考慮事項が必要となります。
この例題では、計算は以下の手順に従います:
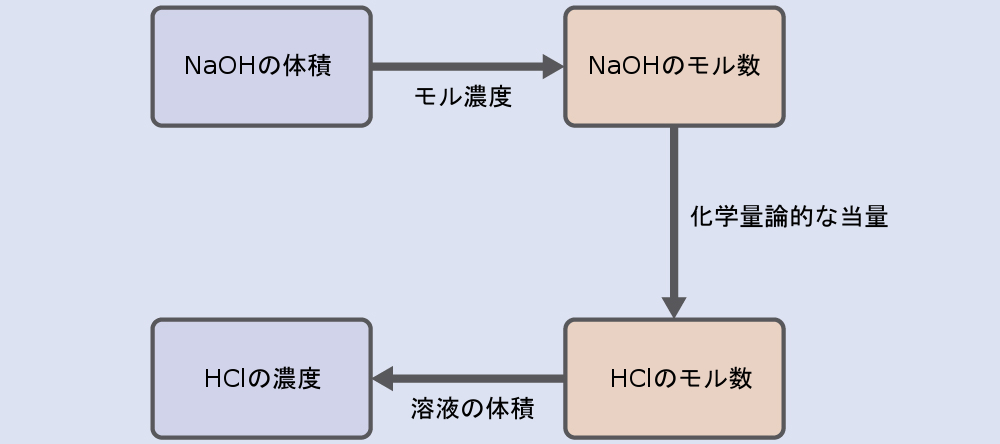
HClのモル量は以下のように計算されます:
\[ \rm 35.23\ mL\ NaOH ×\frac{1\ L}{1000\ mL}×\frac{0.250\ mol\ NaOH}{1\ L}×\frac{1\ mol\ HCl}{1\ mol\ NaOH}= 8.81 × 10^{−3}\ mol\ HCl \]
与えられたHCl溶液の量とモル濃度の定義を使用すると、HCl濃度は以下のようになります:
\[ \begin{eqnarray} M &=&\rm \frac{mol\ HCl}{L\ 溶液}\\ M &=&\rm \frac{8.81 × 10^{−3}\ mol\ HCl}{50.00\ mL×\frac{1\ L}{1000\ mL}}\\ M &=& 0.176\ M \end{eqnarray} \]
注:これらのタイプの滴定計算では、溶液のモル濃度は、溶液のミリリットルあたりの溶質のミリモルの数字にも等しいことを認識しておくと便利です:
\[ M =\rm \frac{mol\ 溶質}{L\ 溶液}×\frac{\frac{10^3\ mmol}{mol}}{\frac{10^3\ mL}{L}}=\frac{mmol\ 溶質}{mL\ 溶液} \]
このバージョンのモル濃度単位を使用すると、2つの変換係数を省くことにより計算が短縮されます:
\[ {\rm \frac{35.23\ mL\ NaOH ×\frac{0.250\ mmol\ NaOH}{mL\ NaOH}×\frac{1\ mmol\ HCl}{1\ mmol\ NaOH}}{50.00\ mL\ 溶液}= 0.176\ }M\rm \ HCl \]
学習内容の確認
20.00 mL のシュウ酸水溶液(H₂C₂O₄)を 0.09113M の過マンガン酸カリウム溶液(KMnO₄)で滴定しました。
\[ \rm 2MnO_4\ ^−\ (aq) + 5H_2 C_2 O_4\ (aq) + 6H^+\ (aq) ⟶ 10CO_2\ (g) + 2Mn^{2+}\ (aq) + 8H_2 O\ (l) \]
終点に到達するまでには23.24mLの体積が必要でした。シュウ酸のモル濃度は何ですか?
解答:0.2648 M
重量分析法
重量分析とは、被分析物の物理的状態の変化を引き起こして被分析物を試料の他の成分から分離することができるような何らかの処理を試料に施すものです。試料、分離された被分析物、または分析する系の他の成分の質量測定と、関与する化合物の既知の化学量論とを一緒に使用することにより、被分析物の濃度の計算が可能になります。重量分析法は、定量的な化学分析のために使用された最初の技術であり、それらは現代の化学実験室でも重要なツールとして残っています。
重量分析において必要な状態の変化は、さまざまな物理的および化学的プロセスによって達成されることがあります。たとえば、試料の水分(水)含有量は、水を蒸発させるように制御された加熱プロセスにさらされる前と後の試料の質量を測定することによって、決まりきった形で決定されます。また、被分析物がこの章で先に説明した種類の沈殿反応の対象となるような重量分析技術も一般的です。沈殿物は通常、濾過によって反応混合物から分離され、慎重に乾燥され、次に計量されます(図4.17)。沈殿物の質量と関連する化学量論的な関係とを使って、被分析物の濃度を計算することができます。

図4.17 | 沈殿物は濾過によって反応混合物から取り除くことができます。
例題4.15 重量分析
MgSO₄を含む0.4550gの固体混合物を水に溶解し、過剰なBa(NO₃)₂で処理すると、0.6168gのBaSO₄が沈殿しました。
\[ \rm MgSO_4\ (aq) + Ba(NO_3)_2\ (aq) ⟶ BaSO_4\ (s) + Mg(NO_3)_2\ (aq) \]
混合物の中のMgSO₄の濃度(質量パーセント)は何ですか?
解法
この計算の進め方は、化学量論的計算で使用された他のものと同様であり、中心的なステップは、BaSO₄とMgSO₄の化学量論的な当量を介してそれらのモルの間を接続することです。MgSO₄の質量が計算されたら、それと試料の混合物の質量とを一緒に使用して、求めるパーセント濃度を計算します。
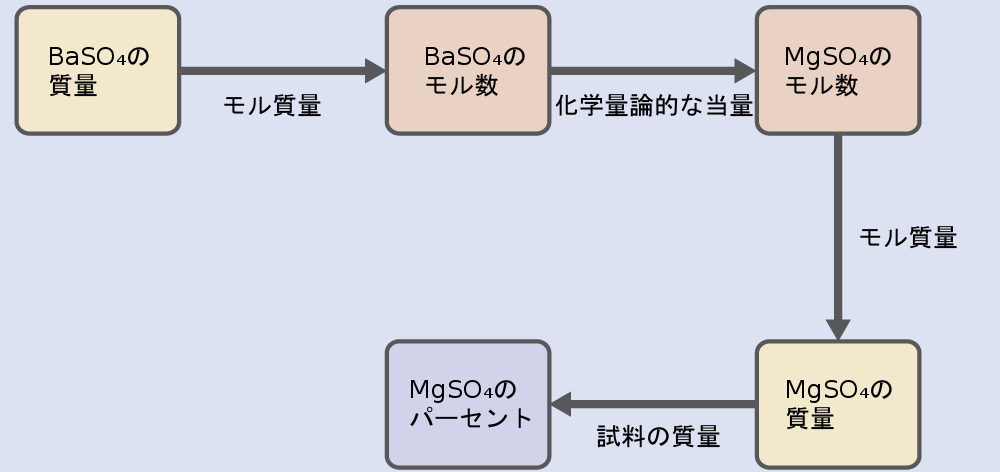
与えられた沈殿物の質量をもたらすMgSO₄の質量は以下の通りです。
\[ \rm 0.6168\ g\ BaSO_4 ×\frac{1\ mol\ BaSO_4}{233.43\ g\ BaSO_4}×\frac{1\ mol\ MgSO_4}{1\ mol\ BaSO_4}×\frac{120.37\ g\ MgSO_4}{1\ mol\ MgSO_4}= 0.3181\ g\ MgSO_4 \]
そして、試料の混合物中のMgSO₄の濃度は、以下のように計算されます。
\[ \rm パーセント\ MgSO_4 =\frac{質量\ MgSO_4}{質量\ 試料}× 100%\\ \frac{0.3181\ g}{0.4550\ g}× 100% = 69.91% \]
学習内容の確認
1.1324 g の試料を過剰なAg⁺で処理したときに1.0881gのAgClが生成された場合、試料中の塩化物イオンの割合は何パーセントですか?
\[ \rm Ag^+\ (aq) + Cl^−\ (aq) ⟶ AgCl\ (s) \]
解答:23.76%
炭化水素および関連化合物の元素組成は、燃焼分析として知られている重量分析法によって決定されることがあります。燃焼分析では、化合物の計量された試料を酸素気体の流れの下で高温に加熱し、結果として既知の正体を持つ気体状生成物を得ることができるように完全燃焼させます。たとえば、炭化水素の完全燃焼では、二酸化炭素と水だけが生成物として得られます。気体状の燃焼生成物は、それぞれの生成物を選択的に吸収する化合物を含むような、個別の予め計量された収集装置を通過します(図4.18)。それぞれの装置の質量の増加は吸収された生成物の質量に対応しており、これを適切な化学量論計算で使用して、関連する元素の質量を導き出すことができます。
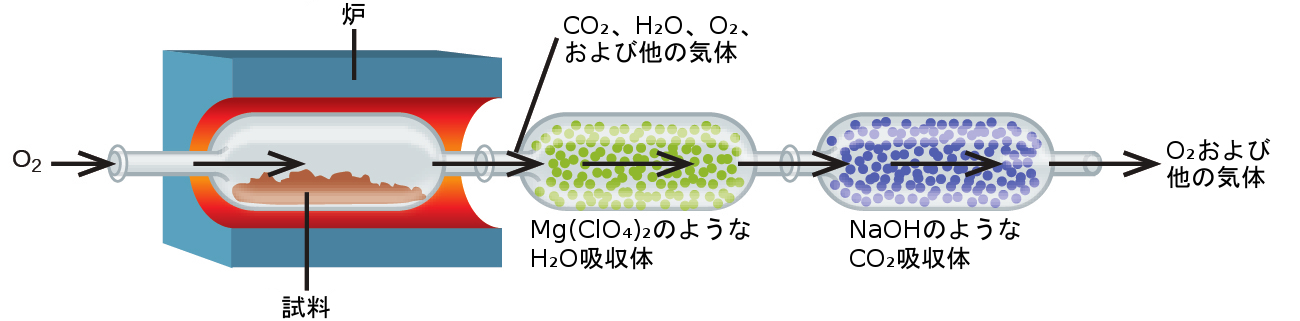
図4.18 | この模式図は、試料の炭素含有量と水素含有量を決定するための燃焼分析装置の基本的な構成要素を示しています。
例題4.16 燃焼分析
ポリエチレンは、食品保存容器やその他多くの柔軟性のあるプラスチック製品の製造に使用される炭化水素ポリマーです。0.00126gのポリエチレンの試料の燃焼分析では、0.00394gのCO₂と0.00161gのH₂Oが得られました。ポリエチレンの経験式は何ですか?
解法
この例題の主たる仮定は、燃焼した試料中のすべての炭素が二酸化炭素に変換され、試料中のすべての水素が水に変換されるということです:
\[ {\rm C}_x {\rm H}_y\ {\rm (s)} + 過剰な{\rm O_2\ (g)} ⟶ x{\rm CO_2\ (g)} +\frac{y}{2}{\rm H_2 O\ (g)} \]
バランスの取れた反応式は、目下の課題には必要ないことに注意してください。化合物の経験式を導出するために必要なのは、添え字xとyだけです。
最初に、与えられた二酸化炭素と水の質量をそれぞれ使用して、試料中の炭素と水素のモル量を計算します。これらのモル量を用いて、この教科書の前の章で説明したように、化合物の経験式を書きます。このアプローチの概要は以下のフローチャートに示されています:
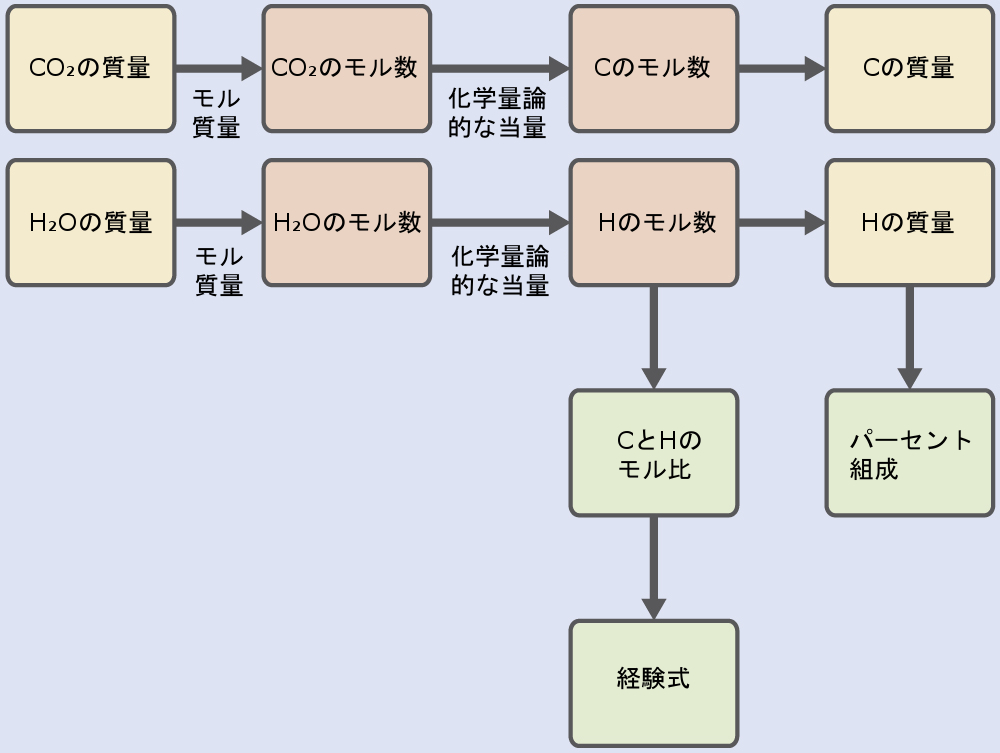
\[ \rm mol\ C = 0.00394\ g\ CO_2 ×\frac{1\ mol\ CO_2}{44.01\ g}×\frac{1\ mol\ C}{1\ mol\ CO_2}= 8.95 × 10^{−5}\ mol\ C\\ mol\ H = 0.00161\ g\ H_2 O×\frac{1\ mol\ H_2 O}{18.02\ g}×\frac{2\ mol\ H}{1\ mol\ H_2 O}= 1.79 × 10^{−4}\ mol\ H \]
次に、これらのモル量の最小の整数倍を特定することにより、化合物の経験式が導出されます。HとCのモル比は
\[ \rm \frac{mol\ H}{mol\ C}=\frac{1.79 × 10^{−4}\ mol\ H}{8.95 × 10^{−5}\ mol\ C}=\frac{2\ mol\ H}{1\ mol\ C} \]
であり、ポリエチレンの経験式はCH₂です。
学習内容の確認
炭素と水素からなるポリマーであるポリスチレンの0.00215gの試料を燃焼分析したところ、0.00726gのCO₂と0.00148gのH₂Oが生成されました。ポリスチレンの経験式は何ですか?
解答:CH
重要用語
酸:水に溶解するとH₃O⁺を生成する物質
酸-塩基反応:反応物の種の間での水素イオンの移動を伴う反応
実際の収量:反応で形成された生成物の量
被分析物:関心のある化学種
バランスの取れた反応式:反応物と生成物に含まれるそれぞれの元素の原子の数が等しい化学反応式
塩基:水に溶解したときにOH⁻を生成する物質
ビュレット:滴定分析などの際に、液体の可変の体積を正確に与えるために使用される装置
化学反応式:化学反応の記号表現
係数:化学反応式の記号または式の前に配置され、それらの相対量を示す数値
燃焼分析:気体状の燃焼生成物の収集と計量によって化合物の元素組成を決定するために使用される重量分析技術
燃焼反応:熱と、時には光の形で大量のエネルギーを生成する激しい酸化-還元反応
完全なイオン反応式:傍観イオンを含むすべての溶解したイオン反応物およびイオン生成物が、解離したイオンの式によって明示的に表される化学反応式
終点:化学量論的な当量で予想されるような試料溶液の外観またはその他の性質の変化をもたらす滴定溶液の測定された体積(当量点を参照)
当量点:滴定分析において被分析物と完全に反応するために必要な滴定溶液の体積。滴定反応に従って、試料の被分析物にとって化学量論的な量の滴定剤を与える
過剰な反応物:反応の化学量論で必要とされるよりも多い量で存在する反応物
重量分析:物理的または化学的プロセスによる試料からの被分析物の分離と、それに続く被分析物、反応生成物、および/または試料の質量測定とを含む定量的な化学分析方法
半反応:それぞれの反応物が反応で電子を失うか獲得するかを示す反応式
指示薬:終点を視覚的に検出できるように滴定分析で試料に添加される物質
不溶性:溶解度が比較的低いこと。わずかな程度だけ溶解する
限定反応物:反応の化学量論で必要とされるよりも少ない量で存在し、したがって生成される生成物の量を限定するような反応物
分子反応式:すべての反応物と生成物が中性物質として表される化学反応式
正味イオン反応式:化学的または物理的変化を受ける溶解したイオン反応物および生成物のみが表される化学反応式(傍観イオンを除く)
中和反応:塩と水を生成する、酸と塩基の間の反応
酸化:電子の損失によって元素の酸化数が増加するプロセス
酸化数(または、酸化状態):化合物がイオン性である場合、ある元素のそれぞれの原子が化合物の中で持つであろう電荷
酸化-還元反応:1つかそれ以上の反応元素の酸化数の変化を伴う反応
酸化剤(または、酸化体):他の物質の酸化を引き起こし、その過程で還元される物質
パーセント収率:理論収量のパーセンテージとして表される、反応の効率の尺度
沈殿物:可溶性の反応物の反応から形成される不溶性の生成物
沈殿反応:1つかそれ以上の不溶性の生成物を生成する反応。反応物がイオン化合物の場合、二重置換または複分解と呼ばれることもある
生成物:化学的または物理的変化によって形成される物質。化学反応式の矢印の右側に示される
定量分析:試料中の物質の量または濃度を決定すること
反応物:化学的または物理的変化を受ける物質。化学反応式の矢印の左側に示される
還元剤(または、還元体):別の物質の還元を引き起こし、その過程で酸化される物質
還元:電子の獲得によって元素の酸化数が減少するプロセス
塩:酸と、水酸化物または酸化物以外のカチオンおよびアニオンを含む塩基との反応によって形成されるイオン化合物
単純置換反応(または、置換反応):イオン種による元素の物質の酸化を伴う酸化-還元反応
溶解度:物質が水または任意の溶媒に溶解する程度
可溶性:溶解度が比較的高いこと。比較的大きな程度で溶解する
傍観イオン:反応中に化学的または物理的変化を受けないが、電荷の中性を維持するためにその存在が必要なイオン
化学量論的な当量:反応物と生成物の量に関連する計算で使用される、バランスの取れた化学反応式の係数の比率
化学量論:化学反応における反応物と生成物の量の関係
強酸:ヒドロニウムイオンを生成するために水に溶解するときに、完全に反応する酸
強塩基:水酸化物イオンを生成するために水に溶解するときに、完全に反応する塩基
理論収量:反応の化学量論に従って、所定の量の反応物から生成され得る生成物の量
滴定剤:滴定分析において被分析物と反応する、既知の濃度の物質を含む溶液
滴定分析:試料中の被分析物と完全に反応するために必要な反応溶液の体積を測定することを含む定量的な化学分析方法
弱酸:ヒドロニウムイオンを生成するために水に溶解するときに、わずかにしか反応しない酸
弱塩基:水酸化物イオンを生成するために水に溶解するときに、わずかにしか反応しない塩基
重要な方程式
\(•パーセント収率 =\frac{実際の収量}{理論収量}× 100\)
この章のまとめ
4.1 化学反応式を書き、バランスを取る
化学反応式は、化学的および物理的変化を記号的に表したものです。変化を受ける物質(反応物)と変化によって生成される物質(生成物)の式は矢印で区切られ、それらの前には相対的な数を示す整数の係数が付けられています。バランスの取れた反応式とは、反応物と生成物に含まれるそれぞれの元素の原子の数が等しくなるような係数を持つ反応式のことです。イオン性の反応物や生成物を含む水溶液中の化学反応は、より現実的には完全なイオン反応式によって、より簡潔には正味イオン反応式によって表されることがあります。
4.2 化学反応を分類する
化学反応は、似たような振る舞いのパターンに従って分類されています。多くの重要な反応は、沈殿反応、酸-塩基反応、酸化-還元反応の3つのカテゴリーに含まれます。沈殿反応は、1つかそれ以上の不溶性の生成物の形成を伴います。酸-塩基反応は、反応物間での水素イオンの移動を伴います。酸化-還元反応では、1つかそれ以上の反応物の元素の酸化数が変化します。水溶液中で起こるいくつかの酸化-還元反応についてのバランスの取れた反応式を書くことは、半反応法と呼ばれる体系的なアプローチを用いることによって簡略化されます。
4.3 反応の化学量論
反応の化学量論(反応物と生成物の量の間の関係性)を記述するために、バランスの取れた化学反応式を使用することができます。この反応式からの係数を用いて化学量論的な当量を導出し、それを反応物と生成物の質量、モル量、その他の定量的な性質に関連する計算に使用することができます。
4.4 反応の収率
化学量論的な量よりも少ない量の反応物を用いて反応を行う場合、生成される生成物の量は限定反応物によって決定されます。化学反応によって生成される生成物の量が、その実際の収量です。この収量は、反応を表すバランスの取れた化学反応式の化学量論によって予測される生成物の量(理論収量)よりもしばしば少ないです。理論的な生成物の量と比べて、反応によってどの程度が生成されたかは、パーセント収率として表されます。
4.5 定量的な化学分析
化学反応の化学量論は、定量的な化学分析方法の基礎となることがあります。滴定では、試料溶液と完全に反応するために必要な滴定溶液の体積を測定します。この体積を用いて、滴定反応の化学量論に基づき試料中の被分析物の濃度を計算します。重量分析では、物理的または化学的なプロセスによって試料から被分析物を分離し、その質量を決定し、関連するプロセスの化学量論に基づいて試料中の被分析物の濃度を計算します。燃焼分析は、化合物の元素組成を決定するために使用される重量分析法であり、燃焼による気体状の生成物を収集し、その重量を測定することによって行われます。
練習問題
4.1 化学反応式を書き、バランスを取る
1.反応式のバランスが取れているとはどういう意味ですか?なぜ反応式のバランスが取れていることが重要なのですか?
2.分子反応式、完全なイオン反応式、正味イオン反応式を考えてみましょう。
(a)これらの種類の反応式の違いは何ですか?
(b)ある反応の完全なイオン反応式と正味イオン反応式が同じになるのはどのような場合でしょうか?
3.以下の反応式のバランスを取ってください:
(a)PCl₅(s) + H₂O(l) ⟶ POCl₃(l) + HCl(aq)
(b)Cu(s) + HNO₃(aq) ⟶ Cu(NO₃)₂(aq) + H₂O(l) + NO(g)
(c)H₂(g) + I₂(s) ⟶ HI(s)
(d)Fe(s) + O₂(g) ⟶ Fe₂O₃(s)
(e)Na(s) + H₂O(l) ⟶ NaOH(aq) + H₂(g)
(f)(NH₄)₂Cr₂O₇(s) ⟶ Cr₂O₃(s) + N₂(g) + H₂O(g)
(g)P₄(s) + Cl₂(g) ⟶ PCl₃(l)
(h)PtCl₄(s) ⟶ Pt(s) + Cl₂(g)
4.以下の反応式のバランスを取ってください:
(a)Ag(s) + H₂S(g) + O₂(g) ⟶ Ag₂S(s) + H₂O(l)
(b)P₄(s) + O₂(g) ⟶ P₄O₁₀(s)
(c)Pb(s) + H₂O(l) + O₂(g) ⟶ Pb(OH)₂(s)
(d)Fe(s) + H₂O(l) ⟶ Fe₃O₄(s) + H₂(g)
(e)Sc₂O₃(s) + SO₃(l) ⟶ Sc₂(SO₄)₃(s)
(f)Ca₃(PO₄)₂(aq) + H₃PO₄(aq) ⟶ Ca(H₂PO₄)₂(aq)
(g)Al(s) + H₂SO₄(aq) ⟶ Al₂(SO₄)₃(s) + H₂(g)
(h)TiCl₄(s) + H₂O(g) ⟶ TiO₂(s) + HCl(g)
5.以下のそれぞれの化学反応を記述するバランスの取れた分子反応式を書いてください。
(a)固体の炭酸カルシウムが加熱されて分解し、固体の酸化カルシウムと二酸化炭素気体になる。
(b)気体のブタン(C₄H₁₀)が二原子の酸素気体と反応して、気体の二酸化炭素と水蒸気を生成する。
(c)塩化マグネシウムと水酸化ナトリウムの水溶液が反応して、固体の水酸化マグネシウムと塩化ナトリウム水溶液を生成する。
(d)水蒸気が金属ナトリウムと反応して、固体の水酸化ナトリウムと水素気体を生成する。
6.以下のそれぞれの化学反応を記述するバランスの取れた反応式を書いてください。
(a)固体の塩素酸カリウム(KClO₃)が分解して、固体の塩化カリウムと二原子の酸素気体を生成する。
(b)固体の金属アルミニウムが固体の二原子のヨウ素と反応して、固体のAl₂I₆を生成する。
(c)固体の塩化ナトリウムを硫酸水溶液に加えると、塩化水素気体と硫酸ナトリウム水溶液が生成される。
(d)リン酸と水酸化カリウムの水溶液が反応して、リン酸二水素カリウムの水溶液と液体の水が生成される。
7.カラフルな花火は、しばしば硝酸バリウムや塩素酸カリウムの分解や、金属であるマグネシウム、アルミニウム、鉄と酸素との反応を伴います。
(a)硝酸バリウムと塩素酸カリウムの式を書いてください。
(b)固体の塩素酸カリウムが分解すると、固体の塩化カリウムと二原子の酸素気体が生成します。この反応の反応式を書いてください。
(c)固体の硝酸バリウムが分解すると、固体の酸化バリウム、二原子の窒素気体、二原子の酸素気体が生成します。この反応の反応式を書いてください。
(d)固体の金属であるマグネシウム、アルミニウム、鉄と二原子の酸素気体との反応によって、対応する金属酸化物が生成する場合の反応式を別々に書いてください。(酸化鉄にはFe³⁺イオンが含まれていると仮定してください。)
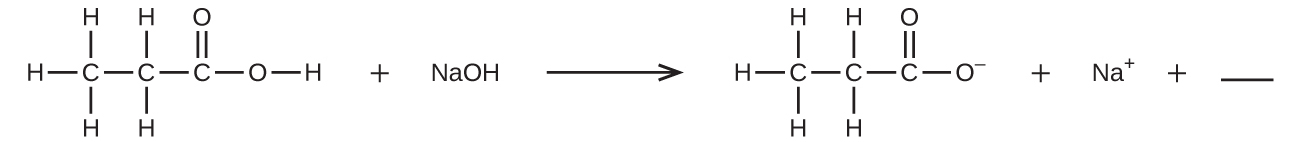
8.以下の反応式のバランスを取るような共有結合化合物の化学式を1つだけ空欄に記入してください。
9.フッ化水素の水溶液(フッ化水素酸)は、ガラスをエッチングしたり、ケイ素を含有する鉱物を分析したりするのに使用されています。フッ化水素はまた、砂(二酸化ケイ素)とも反応します。
(a)固体の二酸化ケイ素とフッ化水素酸が反応して、気体の四フッ化ケイ素と液体の水が得られる反応式を書いてください。
(b)イリノイ州では、鉱物の蛍石(フッ化カルシウム)が広く存在します。固体のフッ化カルシウムはまた、塩化カルシウムおよびフッ化ナトリウムの水溶液の反応によっても調整することができ、このとき他の生成物として塩化ナトリウムの水溶液を生成します。この反応についての完全なイオン反応式と正味イオン反応式を書いてください。
10.海水からマグネシウムを得るための新しいプロセスは、いくつかの反応を含みます。このプロセスのそれぞれの段階についてバランスの取れた化学反応式を書いてください。
(a)第一段階は、貝殻から固体の炭酸カルシウムを分解して、固体の酸化カルシウムと気体の二酸化炭素を生成します。
(b)第二段階は、固体の酸化カルシウムと液体の水との反応から、唯一の生成物としての固体の水酸化カルシウムを形成します。
(c)次いで、固体の水酸化カルシウムを海水に添加し、溶解した塩化マグネシウムと反応させて固体の水酸化マグネシウムおよび塩化カルシウムの水溶液を得ます。
(d)固体の水酸化マグネシウムを塩酸水溶液に添加し、溶解した塩化マグネシウムと液体の水を生成します。
(e)最後に、塩化マグネシウムを溶融して電気分解し、液体の金属マグネシウムと二原子の塩素気体を得ます。
11.以下のものについて、バランスの取れた分子反応式から、完全なイオン反応式と正味イオン反応式を書いてください:
(a)K₂C₂O₄(aq) + Ba(OH)₂(aq) ⟶ 2KOH(aq) + BaC₂O₄(s)
(b)Pb(NO₃)₂(aq) + H₂SO₄(aq) ⟶ PbSO₄(s) + 2HNO₃(aq)
(c)CaCO₃(s) + H₂SO₄(aq) ⟶ CaSO₄(s) + CO₂(g) + H₂O(l)
4.2 化学反応を分類する
12.次の4つの問題に答えるために、以下の反応式を使ってください:
i.H₂O(s) ⟶ H₂O(l)
ii.Na⁺(aq) + Cl⁻(aq) + Ag⁺(aq) + NO₃⁻(aq) ⟶ AgCl(s) + Na⁺(aq) + NO₃⁻(aq)
iii.CH₃OH(g) + O₂(g) ⟶ CO₂(g) + H₂O(g)
iv.2H₂O(l) ⟶ 2H₂(g) + O₂(g)
v.H⁺(aq) + OH⁻(aq) ⟶ H₂O(l)
(a)物理的変化を記述する反応式はどれですか?
(b)燃焼反応の反応物と生成物を特定する反応式はどれですか?
(c)バランスが取れていない反応式はどれですか?
(d)正味イオン反応式はどれですか?
13.以下のそれぞれの反応がどのような種類の反応を表しているかを示してください:
(a)Ca(s) + Br₂(l) ⟶ CaBr₂(s)
(b)Ca(OH)₂(aq) + 2HBr(aq) ⟶ CaBr₂(aq) + 2H₂O(l)
(c)C₆H₁₂(l) + 9O₂(g) ⟶ 6CO₂(g) + 6H₂O(g)
14.以下のそれぞれの反応がどのような種類の反応を表しているかを示してください:
(a)H₂O(g) + C(s) ⟶ CO(g) + H₂(g)
(b)2KClO₃(s) ⟶ 2KCl(s) + 3O₂(g)
(c)Al(OH)₃(aq) + 3HCl(aq) ⟶ AlCl₃(aq) + 3H₂O(l)
(d)Pb(NO₃)₂(aq) + H₂SO₄(aq) ⟶ PbSO₄(s) + 2HNO₃(aq)
15.銀が金から分離できるのは、銀が硝酸に溶けるのに対し、金は溶けないからです。銀が硝酸に溶けるのは酸-塩基反応ですか、酸化-還元反応ですか?あなたの答えを説明してください。
16.以下の化合物に含まれる元素の酸化状態を決定してください:
(a)NaI
(b)GdCl₃
(c)LiNO₃
(d)H₂Se
(e)Mg₂Si
(f)RbO₂、超酸化ルビジウム
(g)HF
17.記載されている化合物に含まれる元素の酸化状態を決定してください。酸素含有化合物はいずれも過酸化物または超酸化物ではありません。
(a)H₃PO₄
(b)Al(OH)₃
(c)SeO₂
(d)KNO₂
(e)In₂S₃
(f)P₄O₆
18.記載されている化合物に含まれる元素の酸化状態を決定してください。酸素含有化合物はいずれも過酸化物または超酸化物ではありません。
(a)H₂SO₄
(b)Ca(OH)₂
(c)BrOH
(d)ClNO₂
(e)TiCl₄
(f)NaH
19.以下のものを酸-塩基反応または酸化-還元反応に分類してください:
(a)Na₂S(aq) + 2HCl(aq) ⟶ 2NaCl(aq) + H₂S(g)
(b)2Na(s) + 2HCl(aq) ⟶ 2NaCl(aq) + H₂(g)
(c)Mg(s) + Cl₂(g) ⟶ MgCl₂(s)
(d)MgO(s) + 2HCl(aq) ⟶ MgCl₂(aq) + H₂O(l)
(e)K₃P(s) + 2O₂(g) ⟶ K₃PO₄(s)
(f)3KOH(aq) + H₃PO₄(aq) ⟶ K₃PO₄(aq) + 3H₂O(l)
20.以下のそれぞれの反応式において、酸化および還元される原子、それぞれの酸化状態の変化、酸化剤および還元剤を特定してください:
(a)Mg(s) + NiCl₂(aq) ⟶ MgCl₂(aq) + Ni(s)
(b)PCl₃(l) + Cl₂(g) ⟶ PCl₅(s)
(c)C₂H₄(g) + 3O₂(g) ⟶ 2CO₂(g) + 2H₂O(g)
(d)Zn(s) + H₂SO₄(aq) ⟶ ZnSO₄(aq) + H₂(g)
(e)2K₂S₂O₃(s) + I₂(s) ⟶ K₂S₄O₆(s) + 2KI(s)
(f)3Cu(s) + 8HNO₃(aq) ⟶ 3Cu(NO₃)₂(aq) + 2NO(g) + 4H₂O(l)
21.以下の酸-塩基の反応式を完成させ、バランスを取ってください:
(a)気体のHClが固体のCa(OH)₂(s)と反応する。
(b)Sr(OH)₂の溶液をHNO₃の溶液に加える。
22.以下の酸-塩基の反応式を完成させ、バランスを取ってください:
(a)HClO₄の溶液をLiOHの溶液に加える。
(b)H₂SO₄の水溶液がNaOHと反応する。
(c)Ba(OH)₂が気体のHFと反応する。
23.酸化される原子に対して可能な限り最高の酸化状態を与えるように、以下の酸化-還元反応を完成させ、バランスを取ってください。
(a)Al(s) + F₂(g) ⟶
(b)Al(s) + CuBr₂(aq) ⟶ (単純置換)
(c)P₄(s) + O₂(g) ⟶
(d)Ca(s) + H₂O(l) ⟶ (生成物は強塩基と二原子気体)
24.酸化される原子に対して可能な限り最高の酸化状態を与えるように、以下の酸化-還元反応を完成させ、バランスを取ってください。
(a)K(s) + H₂O(l) ⟶
(b)Ba(s) + HBr(aq) ⟶
(c)Sn(s) + I₂(s) ⟶
25.以下の酸-塩基中和反応の反応式を完成させ、バランスを取ってください。溶媒として水を用いる場合は、反応物と生成物を水溶性イオンとして書いてください。使用する反応物の量によっては、複数の正解がある場合もあります。
(a)Mg(OH)₂(s) + HClO₄(aq) ⟶
(b)SO₃(g) + H₂O(l) ⟶ (水が過剰であり、生成物が溶解すると仮定してください)
(c)SrO(s) + H₂SO₄(l) ⟶
26.純粋な炭素であるダイヤモンドは、700~800°Cに加熱すると、大気中の酸素によって酸化されます。(ダイヤモンドは燃えます!)この反応についてのバランスの取れた反応式を書いてください。
27.軍では、フッ素と水素が爆発的に結合して非常に強い光を出すレーザーの実験を行っています。この反応についてのバランスの取れた反応式は何ですか?
28.以下の反応についての分子反応式、全イオン反応式、正味イオン反応式を書いてください:
(a)Ca(OH)₂(aq) + HC₂H₃O₂(aq) ⟶
(b)H₃PO₄(aq) + CaCl₂(aq) ⟶
29.グレートレークス化学会社が、アーカンソー州の塩水を塩素気体で処理することによって、NaBrなどの臭化物塩から臭素(Br₂)を製造しています。NaBrとCl₂の反応についてのバランスの取れた反応式を書いてください。
30.一般的な化学実験室でよく行われる実験では、金属マグネシウムを空気中で加熱してMgOを生成させます。MgOは白い固体ですが、この実験では、マグネシウムの一部が窒素と反応して形成された化合物であるMg₃N₂が少量含まれているため、灰色に見えることがよくあります。それぞれの反応についてバランスの取れた反応式を書いてください。
31.水酸化リチウムは、有人宇宙船や潜水艦などの密閉された環境で二酸化炭素を吸収するために使用されることがあります。1molのCO₂あたり、2molのLiOHを含む反応についての反応式を書いてください。(ヒント:水が生成物の1つです。)
32.プロピオン酸カルシウムは、腐敗を遅らせるためにパンに添加されることがあります。この化合物は、炭酸カルシウム(CaCO₃)と、酢酸に似た性質を持つプロピオン酸(C₂H₅CO₂H)とを反応させることで調製することができます。プロピオン酸カルシウムの生成についてのバランスの取れた反応式を書いてください。
33.以下の反応(それぞれ天然ガスから硫化水素を除去するために使用できます)の反応式を完成させ、バランスを取ってください:
(a)Ca(OH)₂(s) + H₂S(g) ⟶
(b)Na₂CO₃(aq) + H₂S(g) ⟶
34.硫化銅(II)は分子の酸素によって酸化され、気体の三酸化硫黄と固体の酸化銅(II)を生成します。その後、気体の生成物は液体の水と反応して、唯一の生成物として液体の硫酸水素を生成します。これらの反応を表す2つの反応式を書いてください。
35.与えられた出発物質から以下のそれぞれの化合物を調製するために使用される反応について、バランスの取れた化学反応式を書いてください。場合によっては、追加の反応物が必要になることもあります。
(a)二段階のプロセスを介して、気体の窒素分子から固体の硝酸アンモニウムを調製する(最初に窒素をアンモニアに還元し、次に適当な酸でアンモニアを中和する)
(b)一段階の酸化-還元反応を介して、液体の臭素分子から気体の臭化水素を調製する
(c)二段階のプロセスを介して、固体のZnとSから気体のH₂Sを調製する(最初に出発物質間の酸化-還元反応、次に生成物と強酸との反応)
36.シクラミン酸カルシウムCa(C₆H₁₁NHSO₃)₂は、世界中の多くの国で使用される人工甘味料ですが、米国では禁止されています。それは、酸C₆H₁₁NHSO₃Hを炭酸バリウムと反応させてバリウム塩に変換すること、硫酸(硫酸バリウムは非常に不溶性です)での処理、そして、水酸化カルシウムでの中和により、工業的に精製することができます。これらの反応についてのバランスの取れた反応式を書いてください。
37.以下の半反応(半反応法のステップ2~5)をそれぞれ完成させ、バランスを取ってください:
(a)Sn⁴⁺(aq) ⟶ Sn²⁺(aq)
(b)[Ag(NH₃)₂]⁺(aq) ⟶ Ag(s) + NH₃(aq)
(c)Hg₂Cl₂(s) ⟶ Hg(l) + Cl⁻(aq)
(d)H₂O(l) ⟶ O₂(g)(酸性溶液の中で)
(e)IO₃⁻(aq) ⟶ I₂(s)(塩基性溶液の中で)
(f)SO₃²⁻(aq) ⟶ SO₄²⁻(aq)(酸性溶液の中で)
(g)MnO₄⁻(aq) ⟶ Mn²⁺(aq)(酸性溶液の中で)
(h)Cl⁻(aq) ⟶ ClO₃⁻(aq)(塩基性溶液の中で)
38.以下の半反応(半反応法のステップ2~5)をそれぞれ完成させ、バランスを取ってください:
(a)Cr²⁺(aq) ⟶ Cr³⁺(aq)
(b)Hg(l) + Br⁻(aq) ⟶ HgBr₄²⁻(aq)
(c)ZnS(s) ⟶ Zn(s) + S²⁻(aq)
(d)H₂(g) ⟶ H₂O(l)(塩基性溶液の中で)
(e)H₂(g) ⟶ H₃O⁺(aq)(酸性溶液の中で)
(f)NO₃⁻(aq) ⟶ HNO₂(aq)(酸性溶液の中で)
(g)MnO₂(s) ⟶ MnO₄⁻(aq)(塩基性溶液の中で)
(h)Cl⁻(aq) ⟶ ClO₃⁻(aq)(酸性溶液の中で)
39.半反応法に従って、以下のそれぞれの反応式のバランスを取ってください:
(a)Sn²⁺(aq) + Cu²⁺(aq) ⟶ Sn⁴⁺(aq) + Cu⁺(aq)
(b)H₂S(g) + Hg₂²⁺(aq) ⟶ Hg(l) + S(s)(酸の中で)
(c)CN⁻(aq) + ClO₂(aq) ⟶ CNO⁻(aq) + Cl⁻(aq)(酸の中で)
(d)Fe²⁺(aq) + Ce⁴⁺(aq) ⟶ Fe³⁺(aq) + Ce³⁺(aq)
(e)HBrO(aq) ⟶ Br⁻(aq) + O₂(g)(酸の中で)
40.半反応法に従って、以下のそれぞれの反応式のバランスを取ってください:
(a)Zn(s) + NO₃⁻(aq) ⟶ Zn²⁺(aq) + N₂(g)(酸の中で)
(b)Zn(s) + NO₃⁻(aq) ⟶ Zn²⁺(aq) + NH₃(aq)(塩基の中で)
(c)CuS(s) + NO₃⁻(aq) ⟶ Cu²⁺(aq) + S(s) + NO(g)(酸の中で)
(d)NH₃(aq) + O₂(g) ⟶ NO₂(g)(気相)
(e)H₂O₂(aq) + MnO₄⁻(aq) ⟶ Mn²⁺(aq) + O₂(g)(酸の中で)
(f)NO₂(g) ⟶ NO₃⁻(aq) + NO₂⁻(aq)(塩基の中で)
(g)Fe³⁺(aq) + I⁻(aq) ⟶ Fe²⁺(aq) + I₂(aq)
41.半反応法に従って、以下のそれぞれの反応式のバランスを取ってください:
(a)MnO₄⁻(aq) + NO₂⁻(aq) ⟶ MnO₂(s) + NO₃⁻(aq)(塩基の中で)
(b)MnO₄²⁻(aq) ⟶ MnO₄⁻(aq) + MnO₂(s)(塩基の中で)
(c)Br₂(l) + SO₂(g) ⟶ Br⁻(aq) + SO₄²⁻(aq)(酸の中で)
4.3 反応の化学量論
42.以下のそれぞれについて、バランスの取れた反応式を書き、求められている情報を決定するために必要な手順を概説してください:
(a)10.0gの金属ナトリウム(Na)と反応して塩化ナトリウム(NaCl)を生成するのに必要な塩素(Cl₂)のモル数と質量。
(b)1.252gの酸化水銀(II)の分解によって生成される酸素のモル数と質量。
(c)128gの酸素を生成するのに必要な硝酸ナトリウム(NaNO₃)のモル数と質量。(他の生成物としてNaNO₂があります。)
(d)20.0kgの炭素を過剰な酸素の中で燃焼させることによって生成される二酸化炭素のモル数と質量。
(e)1.500kgの酸化銅を生成するのに必要な炭酸銅(II)のモル数と質量。(他の生成物としてCO₂があります。)
(f)

43.練習問題4.42のそれぞれの反応で求められているモル数と質量を決定してください。
44.以下のそれぞれについて、バランスの取れた反応式を書き、求められている情報を決定するために必要な手順を概説してください:
(a)5.00gのHClと反応してMgCl₂とH₂を生成するのに必要なMgのモル数と質量。
(b)1.252gの酸化銀(I)の分解によって生成される酸素のモル数と質量。
(c)283gの二酸化炭素を生成するために必要な炭酸マグネシウム(MgCO₃)のモル数と質量。(他の生成物としてMgOがあります。)
(d)20.0kgのアセチレン(C₂H₂)を過剰な酸素の中で燃焼させることによって生成される水のモル数と質量。
(e)2.500kgの酸化バリウム(BaO)を生成するために必要な過酸化バリウム(BaO₂)のモル数と質量。(他の生成物としてO₂があります。)
(f)

45.練習問題4.44のそれぞれの反応で求められているモル数と質量を決定してください。
46.以下の反応式に従って0.8775MのH₃PO₄溶液118.5mLを反応させるとH₂が生成されます:2Cr + 2H₃PO₄ ⟶ 3H₂ + 2CrPO₄
(a)H₂のモル数と質量を決定するために必要な手順を概説してください。
(b)概説された計算を行ってください。
47.以下の反応式に従って1.44MのHCl溶液2.6Lを反応させると塩化ガリウムが生成されます:2Ga + 6HCl ⟶ 2GaCl₃+ 3H₂
(a)塩化ガリウムのモル数と質量を決定するために必要な手順を概説してください。
(b)概説された計算を行ってください。
48.以下の反応式に従って0.4235molのCuCl₂を反応させるとI₂が生成されます:2CuCl₂+ 4KI ⟶ 2CuI + 4KCl + I₂
(a)何モルのI₂が生成されますか?
(b)どれだけの質量のI₂が生成されますか?
49.銀はしばしばK[Ag(CN)₂]のような鉱石から抽出され、以下の反応によって回収されます: \[ \rm 2K[Ag(CN)₂]\ (aq) + Zn\ (s)⟶ 2Ag\ (s) + Zn(CN)₂\ (aq) + 2KCN\ (aq) \]
(a)35.27gのK[Ag(CN)₂]の反応によって、どれだけの分子のZn(CN)₂が生成されますか?
(b)どれだけの質量のZn(CN)₂が生成されますか?
50.酸化銀とスルファジアジンの反応から25.0gのスルファジアジン銀(AgC₁₀H₉N₄SO₂)を生成するためには、どれだけの質量の酸化銀(Ag₂O)が必要ですか?
2C₁₀H₁₀N₄SO₂+ Ag₂O ⟶ 2AgC₁₀H₉N₄SO₂+ H₂O
51.カーボランダムとは、炭化ケイ素(SiC)のことで、紙やすりの研磨材や他の用途で使用される非常に硬い材料です。それは純粋な砂(SiO₂)と炭素を高温で反応させて作られます。この反応の他の生成物として一酸化炭素(CO)があります。この反応についてのバランスの取れた反応式を書き、3.00kgのSiCを生成するのに必要なSiO₂の量を計算してください。
52.自動車のエアバッグは、アジ化ナトリウム(NaN₃)の試料が非常に急速に分解されるときに膨らみます。
2NaN₃(s) ⟶ 2Na(s) + 3N₂(g)
1.25 g/Lの密度で2.6 ft³(73.6 L)の窒素気体を生成するためには、どれだけの質量のアジ化ナトリウムが必要ですか?
53.尿素(CO(NH₂)₂)は、尿素-ホルムアルデヒドプラスチックの製造や肥料として大規模に製造されています。1.00 × 10³kg の炭素を燃焼させることによりCO₂を生成し、その後に以下の反応を行うことで製造できる尿素の最大質量は何ですか?
CO₂(g) + 2NH₃(g) ⟶ CO (NH₂)₂(s) + H₂O(l)
54.ある事故で、2.5kgの硝酸を含む溶液が漏出しました。2kgのNa₂CO₃がすぐに周囲に散布され、反応によりCO₂が放出されました。すべての酸を中和するのに十分なNa₂CO₃が使われたでしょうか?
55.コンパクトカーの高速道路での燃費は1ガロンあたり37.5マイルです。ガソリンが質量で84.2%の炭素を含み、密度が0.8205g/mLの場合、500マイルの旅行中に生成される二酸化炭素の質量を求めてください(1ガロンあたり3.785リットル)。
56.25.0 gのNaClと過剰な硫酸との反応によって生成されたHClから、どれだけの体積の0.750 Mの塩酸溶液を調製することができますか?
NaCl(s) + H₂SO₄(l) ⟶ HCl(g) + NaHSO₄(s)
57.0.3842MのCu(NO₃)₂溶液43.88mLの中のCu(NO₃)₂と正確に反応するのに十分な量のKIを含む0.2089MのKI溶液の体積は何ですか?
2Cu(NO₃)₂+ 4KI ⟶ 2CuI + I₂+ 4KNO₃
58.媒染剤とは、染料と結合して、染色された布地に安定な固定された色を作り出す物質のことです。酢酸カルシウムは媒染剤として使われています。それは酢酸と水酸化カルシウムの反応により作られます。
2CH₃CO₂H + Ca(OH)₂⟶ Ca(CH₃CO₂)₂+ 2H₂O
1.065 g/mLの密度であり、質量で58.0%の酢酸を含む溶液25.0 mL中の酢酸と反応させるために必要なCa(OH)₂の質量は何ですか?
59.鉛白と呼ばれる有毒な顔料であるPb₃(OH)₂(CO₃)₂は、白色絵具ではルチル(TiO₂)に置き換えられています。質量で88.3%のイルメナイト(FeTiO₃)を含む鉱石379グラムから、どれだけのルチル(g)を調製することができますか?
2FeTiO₃+ 4HCl + Cl₂⟶ 2FeCl₃+ 2TiO₂+ 2H₂O
4.4 反応の収率
60.以下の量をある容器に入れます:1.5×10²⁴個の水素原子、1.0molの硫黄、88.0gの二原子酸素。
(a)3つの元素の集まりの合計質量は何グラムですか?
(b)3つの元素の原子のモル数の合計は何モルですか?
(c)3つの元素の混合物が2個の水素原子、1個の硫黄原子、4個の酸素原子を含む分子を持つ化合物を形成したとすると、どの物質が最初に消費されますか?
(d)(c)で記述された変化では、残った元素はそれぞれ、どれだけの数の原子が未反応のままでしょうか?
61.8gのナトリウムと8gの二原子の塩素から塩化ナトリウムを生成する反応の限定反応物は何ですか?
62.私たちが化学反応についての理論収量を計算することができる理由を説明するドルトンの原子論の原則はどれですか?
63.ある学生が、理論的には81 gの収量を得ることができる手順に従って25 gの化合物を単離しました。彼のパーセント収率は何でしたか?
64.1.31gの炭酸カルシウムを加熱することにより0.53gの二酸化炭素の試料を得ました。この反応のパーセント収率は何ですか?
CaCO₃(s) ⟶ CaO(s) + CO₂(s)
65.Freon-12(CCl₂F₂)は、CCl₄とHFとの反応から調製されます。この反応の他の生成物はHClです。32.9 g の CCl₄から 12.5 g の CCl₂F₂を生成する反応のパーセント収率を決定するために必要な手順を概説してください。Freon-12は、オゾンの分解を触媒し、大気中で非常に長い寿命を持っているため、現在では禁止されており、冷媒としてはもはや使用されていません。パーセント収率を決定してください。
66.クエン酸(C₆H₈O₇)は、ジャム、ゼリー、フルーティーな清涼飲料水の成分であり、カビのクロコウジカビ(Aspergillus niger)によるスクロースの発酵を介して工業的に調製されています。この反応を表す反応式は、
C₁₂H₂₂O₁₁+ H₂O + 3O₂⟶ 2C₆H₈O₇+ 4H₂O
収率が 92.30%の場合、正確に1メートルトン(1.000 × 10³kg)のスクロースからどれだけの質量のクエン酸が生成されますか?
67.トルエン(C₆H₅CH₃)は、慎重に制御された条件下では空気によって酸化され、安息香酸(C₆H₅CO₂H)になります。安息香酸は、食品保存料の安息香酸ナトリウム(C₆H₅CO₂Na)の調製に使用されます。1.000 kg のトルエンを 1.21 kg の安息香酸に変換する反応のパーセント収率は何ですか?
2C₆H₅CH₃+ 3O₂⟶ 2C₆H₅CO₂H + 2H₂O
68.実験室での実験において、3.0 mol の H₂と 2.0 mol の I₂の反応により1.0 mol の HI が生成されました。この反応の理論収量をグラムで求め、パーセント収率を求めてください。
69.以下の問題を解くために必要な手順を概説し、その後で計算を行ってください。エーテル(C₂H₅)₂Oは、元々は麻酔薬として使用されていましたが、より安全で効果の高い薬に置き換えられました。エーテルはエタノールと硫酸の反応によって調製されます。
2C₂H₅OH + H₂SO₄⟶ (C₂H₅)₂O + H₂SO₄·H₂O
1.500 L の C₂H₅OH (d = 0.7894 g/mL) の反応から1.17 L (d = 0.7134 g/mL) のエーテルが単離された場合のエーテルのパーセント収率は何ですか?
70.30.0 g のプロパン(C₃H₈)を 75.0 g の酸素で燃焼させたときの限定反応物を決定するために必要な手順を概説してください。限定反応物を決定してください。
71.以下の化学反応式に従って0.50molのCrと0.75molのH₃PO₄が反応したときの限定反応物を決定するために必要な手順を概説してください。
2Cr + 2H₃PO₄⟶ 2CrPO₄+ 3H₂
限定反応物を決定してください。
72.以下のバランスの取れていない反応式に従って1.50gのリチウムと1.50gの窒素が結合して窒化リチウム(高度な電池の部品)を形成するときの限定反応物はどれですか?
Li + N₂⟶ Li₃N
73.ウランは、UO₂(NO₃)₂として溶解し、次に固体のUO₂(C₂O₄)·3H₂Oとして分離することにより、その鉱石から単離することができます。1.481 g の硝酸ウラニル UO₂(NO₃)₂を含む溶液に 0.4031 g のシュウ酸ナトリウムNa₂C₂O₄を加えると、1.073 g の固体UO₂(C₂O₄)·3H₂O が得られます。
Na₂C₂O₄+ UO₂(NO₃)₂+ 3H₂O ⟶ UO₂(C₂O₄)·3H₂O + 2NaNO₃
この反応の限定反応物とパーセント収率を決定してください。
74.15個のC₂H₄分子と8個のCl₂分子から、何個のC₂H₄Cl₂分子を作ることができますか?
75.30個のC原子、25個のH原子、12個のO原子、8個のS原子、14個のN原子から、何個の甘味料のサッカリンの分子を作ることができますか?
76.清涼飲料水のコーラのためのリン酸の製造に用いられる五酸化リンは、酸素中でリンを燃焼させることによって調製されます。
(a)0.200 mol の P₄と 0.200 mol の O₂が P₄+ 5O₂⟶ P₄O₁₀に従って反応するときの限定反応物は何ですか?
(b)この反応から10.0 gのP₄O₁₀が単離された場合のパーセント収率を計算してください。
77.あなたは1兆個(1,000,000,000,000個)の金原子を5ドルで買うことに同意しますか?そうする場合、またはそうしない場合の理由を説明してください。金の現在の価格を http://money.cnn.com/data/commodities/ で調べてみましょう(1トロイオンス=31.1 g)。
4.5 定量的な化学分析
78.0.0100MのCa(OH)₂溶液125 mL を滴定するために必要な0.0105MのHBr溶液の体積は何ですか?
Ca(OH)₂(aq) + 2HBr(aq) ⟶ CaBr₂(aq) + 2H₂O(l)
79.20.0 mLの酸性雨の試料の滴定では、終点に到達するまでに0.0811MのNaOHが1.7 mL必要でした。雨の酸性は硫酸の存在によるものと仮定すると、この雨の試料中の硫酸の濃度はどれだけだったでしょうか?
80.0.2503MのAgNO₃で15.00 mLのNaCl溶液を滴定した際に、終点に到達するために20.22 mLのAgNO₃溶液が必要である場合、NaCl溶液中のNaClの濃度は何ですか?
AgNO₃(aq) + NaCl(aq) ⟶ AgCl(s) + NaNO₃(aq)
81.一般的な医学実験室での血清中の遊離塩化物イオン濃度の測定では、血清試料をHg(NO₃)₂溶液で滴定します。
2Cl⁻(aq) + Hg(NO₃)₂(aq) ⟶ 2NO₃⁻(aq) + HgCl₂(s)
0.25 mLの正常な血清試料が終点に到達するまでに8.25×10⁻⁴MのHg(NO₃)₂(aq)を1.46 mL必要とした場合、血清試料中のCl⁻濃度は何ですか?
82.ジャガイモの皮を商業的に剥くには、ジャガイモを3M~6Mの水酸化ナトリウム溶液に浸し、緩んだ皮に水を吹きかけて取り除きます。12.00mLの水酸化ナトリウム溶液を滴定して終点に到達するために1.65MのHClを30.6mL必要とした場合、水酸化ナトリウム溶液の濃度は適切なものでしょうか?
83.重量0.165 gの臭化ガリウム(GaBr₃)の試料を水に溶かし、硝酸銀(AgNO₃)で処理した結果、0.299 g の AgBr が沈殿しました。これらのデータを用いて、GaBr₃の%Ga(質量で)を計算してください。
84.防虫剤の主成分はナフタレンであり、これは炭素と水素のみを含む分子量約130amuの化合物です。3.000mgのナフタレンの試料が燃焼して10.3mgのCO₂を生成しました。ナフタレンの経験式と分子式を決定してください。
85.ホウ素と水素からなる化合物の0.025gの試料(分子量約28amu)が空気にさらされた際に自然に燃焼し、0.063gのB₂O₃を生成しました。この化合物の経験式と分子式は何ですか?
86.重炭酸ナトリウム(重曹)であるNaHCO₃は、熱水(60°C)に溶解させ、濾過して不溶性不純物を除去し、0°Cに冷却して固体のNaHCO₃を沈殿させ、濾過してその固体を除去し、溶液中に可溶性不純物を残すことによって精製することができます。溶液中に残ったNaHCO₃は回収されません。60°Cの熱水でのNaHCO₃の溶解度は164g/Lです。0°Cの冷水での溶解度は69g/Lです。この方法で精製したときのNaHCO₃のパーセント収率は何ですか?
87.2.50 g の炭酸水素ナトリウムと完全に反応するには、0.600 M のHClの体積はどれだけ必要ですか?
NaHCO₃(aq) + HCl(aq) ⟶ NaCl(aq) + CO₂(g) + H₂O(l)
88.0.2352 gのリン酸水素カリウムと完全に反応するには、0.08892 MのHNO₃の体積はどれだけ必要ですか?
2HNO₃(aq) + K₂HPO₄(aq) ⟶ H₃PO₄(aq) + 2KNO₃(aq)
89.0.1500 M のシュウ酸 15.00 mL を滴定するには、0.3300M の水酸化ナトリウム溶液の体積はどれだけ必要ですか?
C₂O₄H₂(aq) + 2NaOH(aq) ⟶ Na₂C₂O₄(aq) + 2H₂O(l)
90.1.23 × 10⁻⁴M の H₂SO₄濃度を有する酸性雨の試料 50.00 mL を滴定するには、0.00945M の水酸化カリウム溶液の体積はどれだけ必要ですか?
H₂SO₄(aq) + 2KOH(aq) ⟶ K₂SO₄(aq) + 2H₂O(l)
91.固体の水酸化カルシウムCa(OH)₂の試料を、飽和溶液が形成されるまで水中に放置します。この溶液の75.00mLを 5.00 × 10⁻²MのHCl で滴定すると、終点に到達するまでに 36.6 mL の酸が必要でした。
Ca(OH)₂(aq) + 2HCl(aq) ⟶ CaCl₂(aq) + 2H₂O(l)
モル濃度は何ですか?
92.以下の反応式に従って25.0 gのブタン酸と反応して防腐剤のブタン酸カルシウムを形成する際の、Ca(OH)₂の質量は何ですか?
93.0.0656MのH₃PO₄溶液40.00 mL を滴定するには、0.1500MのKOH溶液は何ミリリットル必要ですか?
H₃PO₄(aq) + 2KOH(aq) ⟶ K₂HPO₄(aq) + 2H₂O(l)
94.フタル酸水素カリウムKHC₈H₅O₄は、KHPとも呼ばれ、一般的な化学実験室を含む多くの実験室で塩基の溶液を標準化するために使用されています。KHPは、温めて乾燥させ、計量することができる数少ない安定した固体酸の1つです。ある滴定では、KHC₈H₅O₄の試料0.3420gが、35.73mLのNaOH溶液と反応しました。NaOHのモル濃度は何ですか?
KHC₈H₅O₄(aq) + NaOH(aq) ⟶ KNaC₈H₅O₄(aq) + H₂O(aq)
95.約400°CでWCl₆とAlとを反応させることにより、タングステンと塩素のみを含む化合物の黒い結晶が得られます。この化合物の試料を水素で還元すると、0.2232gのタングステン金属と塩化水素が得られ、塩化水素は水に吸収されます。このようにして生成された塩酸を滴定すると、終点に到達するために0.1051MのNaOHが46.2 mL必要でした。黒色の塩化タングステンの経験式は何ですか?
解答のヒント
1.反応式は、反応側と生成側で表されているそれぞれの元素の数が同じであればバランスが取れています。物質の保存の法則を正確に反映させるためには、反応式はバランスが取れていなければなりません。
3.(a)PCl₅(s) + H₂O(l) ⟶ POCl₃(l) + 2HCl(aq)、(b)3Cu(s) + 8HNO₃(aq) ⟶ 3Cu(NO₃)₂(aq) + 4H₂O(l) + 2NO(g)、(c)H₂(g) + I₂(s) ⟶ 2HI(s)、(d)4Fe(s) + 3O₂(g) ⟶ 2Fe₂O₃(s)、(e)2Na(s) + 2H₂O(l) ⟶ 2NaOH(aq) + H₂(g)、(f)(NH₄)₂Cr₂O₇(s) ⟶ Cr₂O₃(s) + N₂(g) + 4H₂O(g)、(g)P₄(s) + 6Cl₂(g) ⟶ 4PCl₃(l)、(h)PtCl₄(s) ⟶ Pt(s) + 2Cl₂(g)
5.(a)CaCO₃(s) ⟶ CaO(s) + CO₂(g)、(b)2C₄H 10 (g) + 13O₂(g) ⟶ 8CO₂(g) + 10H₂O(g)、(c)MgCl₂(aq) + 2NaOH(aq) ⟶ Mg(OH)₂(s) + 2NaCl(aq)、(d)2H₂O(g) + 2Na(s) ⟶ 2NaOH(s) + H₂(g)
7.(a)Ba(NO₃)₂、KClO₃、(b)2KClO₃(s) ⟶ 2KCl(s) + 3O₂(g)、(c)2Ba(NO₃)₂(s) ⟶ 2BaO(s) + 2N₂(g) + 5O₂(g)、(d)2Mg(s) + O₂(g) ⟶ 2MgO(s)、4Al(s) + 3O₂(g) ⟶ 2Al₂O₃(s)、4Fe(s) + 3O₂(g) ⟶ 2Fe₂O₃(s)
9.(a)4HF(aq) + SiO₂(s) ⟶ SiF₄(g) + 2H₂O(l)、(b)完全なイオン反応式: 2Na⁺(aq) + 2F⁻(aq) + Ca²⁺(aq) + 2Cl⁻(aq) ⟶ CaF₂(s) + 2Na⁺(aq) + 2Cl⁻(aq)、正味イオン反応式: 2F⁻(aq) + Ca²⁺(aq) ⟶ CaF₂(s)
11.(a)2K⁺(aq) + C₂O₄²⁻(aq) + Ba²⁺(aq) + 2OH⁻(aq) ⟶ 2K⁺(aq) + 2OH⁻(aq) + BaC₂O₄(s)(完全)
Ba²⁺(aq) + C₂O₄²⁻(aq) ⟶ BaC₂O₄(s)(正味)
(b)Pb²⁺(aq) + 2NO₃⁻(aq) + 2H⁺(aq) + SO₄²⁻(aq) ⟶ PbSO₄(s) + 2H⁺(aq) + 2NO₃⁻(aq)(完全)
Pb²⁺(aq) + SO₄²⁻(aq) ⟶ PbSO₄(s)(正味)
(c)CaCO₃(s) + 2H⁺(aq) + SO₄²⁻(aq) ⟶ CaSO₄(s) + CO₂(g) + H₂O(l)(完全)
CaCO₃(s) + 2H⁺(aq) + SO₄²⁻(aq) ⟶ CaSO₄(s) + CO₂(g) + H₂O(l)(正味)
13.(a)酸化-還元(添加)、(b)酸-塩基(中和)、(c)酸化-還元(燃焼)
15.それは酸化-還元反応です。なぜなら、銀の酸化状態が反応の間に変化するからです。
17.(a)H +1、P +5、O −2、(b)Al +3、H +1、O −2、(c)Se +4、O −2、(d)K +1、N +3、O −2、(e)In +3、S −2、(f)P +3、O −2
19.(a)酸-塩基、(b)酸化-還元:Naが酸化され、H⁺が還元されます。(c)酸化-還元:Mgが酸化され、Cl₂が還元されます。(d)酸-塩基、(e)酸化-還元:P³⁻が酸化され、O₂が還元されます。(f)酸-塩基
21.(a)2HCl(g) + Ca(OH)₂(s) ⟶ CaCl₂(s) + 2H₂O(l)、(b)Sr(OH)₂(aq) + 2HNO₃(aq) ⟶ Sr(NO₃)₂(aq) + 2H₂O(l)
23.(a)2Al(s) + 3F₂(g) ⟶ 2AlF₃(s)、(b)2Al(s) + 3CuBr₂(aq) ⟶ 3Cu(s) + 2AlBr₃(aq)、(c)P₄(s) + 5O₂(g) ⟶ P₄O₁₀(s)、(d)Ca(s) + 2H₂O(l) ⟶ Ca(OH)₂(aq) + H₂(g)
25.(a)Mg(OH)₂(s) + 2HClO₄(aq) ⟶ Mg²⁺(aq) + 2ClO₄⁻(aq) + 2H₂O(l)、(b)SO₃(g) + 2H₂O(l) ⟶ H₃O⁺(aq) + HSO₄⁻(aq)、(H₂SO₄の溶液)、(c)SrO(s) + H₂SO₄(l) ⟶ SrSO₄(s) + H₂O
27.H₂(g) + F₂(g) ⟶ 2HF(g)
29.2NaBr(aq) + Cl₂(g) ⟶ 2NaCl(aq) + Br₂(l)
31.2LiOH(aq) + CO₂(g) ⟶ Li₂CO₃(aq) + H₂O(l)
33.(a)Ca(OH)₂(s) + H₂S(g) ⟶ CaS(s) + 2H₂O(l)、(b)Na₂CO₃(aq) + H₂S(g) ⟶ Na₂S(aq) + CO₂(g) + H₂O(l)
35.(a)ステップ1:N₂(g) + 3H₂(g) ⟶ 2NH₃(g)、ステップ2:NH₃(g) + HNO₃(aq) ⟶ NH₄NO₃(aq) ⟶ NH₄NO₃(s)(乾燥後)、(b)H₂(g) + Br₂(l) ⟶ 2HBr(g)、(c)Zn(s) + S(s) ⟶ ZnS(s) および ZnS(s) + 2HCl(aq) ⟶ ZnCl₂(aq) + H₂S(g)
37.(a)Sn⁴⁺(aq) + 2e⁻⟶ Sn²⁺(aq)、(b)[Ag(NH₃)₂]⁺(aq) + e⁻⟶ Ag(s) + 2NH₃(aq)、(c)Hg₂Cl₂(s) + 2e⁻⟶ 2Hg(l) + 2Cl⁻(aq)、(d)2H₂O(l) ⟶ O₂(g) + 4H⁺(aq) + 4e⁻、(e)6H₂O(l) + 2IO₃⁻(aq) + 10e⁻⟶ I₂(s) + 12OH⁻(aq)、(f)H₂O(l) + SO₃²⁻(aq) ⟶ SO₄²⁻(aq) + 2H⁺(aq) + 2e⁻、(g)8H⁺(aq) + MnO₄⁻(aq) + 5e⁻⟶ Mn²⁺(aq) + 4H₂O(l)、(h)Cl⁻(aq) + 6OH⁻(aq) ⟶ ClO₃⁻(aq) + 3H₂O(l) + 6e⁻
39.(a)Sn²⁺(aq) + 2Cu²⁺(aq) ⟶ Sn⁴⁺(aq) + 2Cu⁺(aq)、(b)H₂S(g) + Hg₂²⁺(aq) + 2H₂O(l) ⟶ 2Hg(l) + S(s) + 2H₃O⁺(aq)、(c)5CN⁻(aq) + 2ClO₂(aq) + 3H₂O(l) ⟶ 5CNO⁻(aq) + 2Cl⁻(aq) + 2H₃O⁺(aq)、(d)Fe²⁺(aq) + Ce⁴⁺(aq) ⟶ Fe³⁺(aq) + Ce³⁺(aq)、(e)2HBrO(aq) + 2H₂O(l) ⟶ 2H₃O⁺(aq) + 2Br⁻(aq) + O₂(g)
41.(a)2MnO₄⁻(aq) + 3NO₂⁻(aq) + H₂O(l) ⟶ 2MnO₂(s) + 3NO₃⁻(aq) + 2OH⁻(aq)、(b)3MnO₄²⁻(aq) + 2H₂O(l) ⟶ 2MnO₄⁻(aq) + 4OH⁻(aq) + MnO₂(s)(塩基の中で)、(c)Br₂(l) + SO₂(g) + 2H₂O(l) ⟶ 4H⁺(aq) + 2Br⁻(aq) + SO₄²⁻(aq)
43.(a)0.435 molのNa、0.217 molのCl₂、15.4 gのCl₂、(b)0.005780 molのHgO、2.890 × 10⁻³molのO₂、9.248 × 10⁻²gのO₂、(c)8.00 molのNaNO₃、6.8 × 10²gのNaNO₃、(d)1665 molのCO₂、73.3 kgのCO₂、(e)18.86 molのCuO、2.330 kgのCuCO₃、(f)0.4580 molのC₂H₄Br₂、86.05 gのC₂H₄Br₂
45.(a)0.0686 molのMg、1.67 gのMg、(b)2.701 × 10⁻³molのO₂、0.08644 gのO₂、(c)6.43 molのMgCO₃、542 gのMgCO₃、(d)713 molのH₂O、12.8 kgのH₂O、(e)16.31 molのBaO₂、2762 gのBaO₂、(f)0.207 molのC₂H₄、5.81 gのC₂H₄
47.(a)HCl溶液の体積 ⟶ mol HCl ⟶ mol GaCl₃、(b)1.25 molのGaCl₃、2.2 × 10²g GaCl₃
49.(a)5.337 × 10²²個の分子、(b)10.41 gのZn(CN)₂
51.SiO₂+ 3C ⟶ SiC + 2CO、4.50 kgのSiO₂
53.5.00 × 10³kg
55.1.28 × 10⁵g CO₂
57.161.4 mL KI溶液
59.176 g TiO₂
61.限定反応物はCl₂。
63.パーセント収率 = 31%
65.g CCl₄⟶ mol CCl₄⟶ mol CCl₂F₂⟶ g CCl₂F₂、パーセント収率 = 48.3%
67.パーセント収率 = 91.3%
69.エタノールの質量をエタノールのモル数に変換します。バランスの取れた反応式の化学量論を使用して、エタノ ールのモル数と生成されたエーテルのモル数を関連付けます。エーテルのモル数をグラムに変換します。エーテルの実際のグラム(密度によって決定されます)を理論的な質量で割ってパーセント収率を決定します。87.6%
71.必要な変換はmol Cr ⟶ molH₃PO₄。そして、Crの量と存在する酸の量を比較します。Crが限定反応物です。
73.Na₂C₂O₄が限定反応物です。パーセント収率 = 86.56%
75.4つの分子だけが作られます。
77.この量は通常の秤では重さが測れないものであり、価値がありません。
79.3.4 × 10⁻³M H₂SO₄
81.9.6 × 10⁻³M Cl⁻
83.22.4%
85.経験式はBH₃です。分子式はB₂H₆です。
87.49.6 mL
89.13.64 mL
91.0.0122 M
93.34.99 mL KOH
95.経験式はWCl₄です。
[1]「電荷のバランス」の要件は、問題となっている種が電子である場合における「質量のバランス」の特定のタイプに過ぎません。反応式は、反応側と生成側で等しい数の電子を表現しなければならないので、原子と電荷の両方がバランスが取れていなければなりません。
この訳文は元の本のCreative Commons BY 4.0ライセンスに従って同ライセンスにて公開します。問題がありましたら、可能な限り早く対応いたしますので、ご連絡ください。また、誤訳・不適切な表現等ありましたらご指摘ください。この本は、https://openstax.org/details/books/chemistry-2eで無料でダウンロードできます。