第9章 気体

図9.1 | これらの気球の内部の熱い空気は、周囲の冷たい空気よりも密度が低くなっています。これは、係留している綱がほどかれたときに気球が上昇する浮力をもたらします。(credit: modification of work by Anthony Quintano)
この章の概要
9.1 気体の圧力
9.2 圧力、体積、量、および温度を関係付ける:理想気体の法則
9.3 気体の物質、混合物、反応の化学量論
9.4 気体の浸出と拡散
9.5 分子運動論
9.6 非理想気体の振る舞い
はじめに
私たちの周りには気体の海、つまり大気があり、気体の性質の多くは私たちの日常生活の中で身近なものとなっています。加熱された気体は膨張し、熱気球を上昇させたり(図9.1)、暑い日に太陽の下に放置された自転車のタイヤを破裂させたりします。
気体は化学の発展に重要な役割を果たしてきました。17世紀から18世紀にかけて、多くの科学者が気体の振る舞いを研究し、物質の振る舞いについての数学的な記述を始めて提供しました。
この章では、私たちは気体の温度、圧力、量、体積の間の関係性を調べます。私たちは簡単な理論モデルを学び、それを用いて気体の実験的な振る舞いを分析します。その分析の結果は、この理論の限界、およびそれをどのように改善するかを明らかにしてくれるでしょう。
9.1 気体の圧力
この節が終わるまでに、あなたは次のことができるようになります:
•圧力の性質を定義する
•圧力測定のいくつかの単位を定義し、変換する
•気体の圧力を測定するための一般的な道具の操作を記述する
•マノメーターのデータから圧力を計算する
地球の大気は、他の気体と同じように圧力をかけています。通常、私たちは大気圧に気づくことはありませんが、私たちは圧力の変化に敏感です(たとえば、飛行機での離陸や着陸の際に耳が「ポッ」と鳴るときや、水中に潜ったときなど)。気体の圧力は、気体分子が物体の表面に衝突することでかけられる力によって発生します(図9.2)。それぞれの衝突の力は非常に小さいですが、面積の大きい表面であれば、短時間に多数の衝突が発生し、その結果、高い圧力が発生することがあります。実際、通常の大気圧は、容器の内部からの等しい圧力によってバランスが取られていない場合には、金属容器を押しつぶすのに十分な強さを持っています。
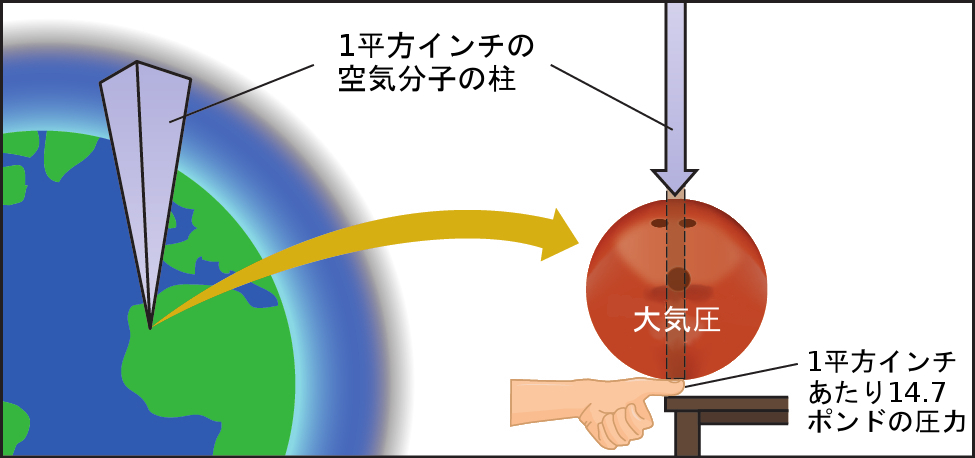
図9.2 | 私たちの上にある大気は地表の物体に大きな圧力をかけていますが、その大きさはボウリングのボールの重さが人間の親指の爪ほどのサイズの領域を押しているのとほぼ同じです。
学習へのリンク
この短いビデオでは、大気圧の劇的な例(http://openstaxcollege.org/l/16atmospressur1)が提供されています。そこでは、鉄道のタンク車の内圧が低下したときに内破する様子が示されています。
この現象のより小さなスケールでの実演(http://openstaxcollege.org/l/16atmospressur2)が、簡単に説明されています。
大気圧は、タンク車のような物体の上にある大気中の空気分子の柱の重さによって引き起こされます。海面では、この圧力は、ドアマットの上に立っている十分に成長したアフリカゾウが及ぼす圧力、または親指の爪の上に乗っている典型的なボウリングのボールが及ぼす圧力とほぼ同じです。これらは巨大な大きさのように見えるかもしれませんし、実際にそうなのですが、地球上の生命はこのような大気圧の下で進化してきたのです。もしあなたが実際にボウリングのボールを親指の爪に乗せてみると、通常の2倍の圧力がかかり、不快な感覚になります。
一般的に、圧力とは、所与の領域にかかる力と定義されています:P=F/A。圧力は力に正比例し、面積に反比例することに注意してください。したがって、圧力は、力の量を増やすことによって、あるいは力がかけられる面積を小さくすることによって増加させることができます。また、圧力は、力を小さくするか面積を大きくすることによって減少させることができます。
この考え方を応用して、図9.3のゾウとフィギュアスケートの選手とでは、どちらの方が薄い氷を踏み抜いて落ちてしまいやすいかを考えてみましょう。大きなアフリカゾウの体重は7トンで、4本の足で支えられています。足のそれぞれは直径約1.5ft(足裏の面積は250in²)なので、それぞれの足にかかる圧力は約14lb/in²です:
\[ \rm ゾウの足あたりの圧力 = 14,000\frac{lb}{ゾウ}×\frac{1頭のゾウ}{4本の足}×\frac{1本の足}{250\ in^2}= 14\ lb/in^2 \]
フィギュアスケートの選手は約120ポンドの重量であり、それは2枚のスケートの刃で支えられています。スケートの刃はそれぞれ約2in²の面積を持つので、1枚の刃にかかる圧力は約30lb/in²です:
\[ \rm スケートの刃あたりの圧力 = 120\frac{lb}{スケート選手}×\frac{1人のスケート選手}{2枚の刃}×\frac{1枚の刃}{2\ in^2}= 30\ lb/in^2 \]
ゾウはスケート選手の100倍以上の重さがあるにもかかわらず、その圧力は2分の1以下であるため、薄い氷でも落ちる可能性は低いでしょう。一方、もしスケート選手がスケート靴を脱いで素足(または普通の靴)で氷の上に立つと、体重がかかる面積が大きくなるため、かかる圧力が大幅に軽減されます:
\[ \rm 人間の足あたりの圧力 = 120\frac{lb}{スケート選手}×\frac{1人のスケート選手}{2本の足}×\frac{1本の足}{30\ in^2}= 2\ lb/in^2 \]

図9.3 | (a)ゾウの体重は大きく、地面に大きな力がかかりますが、(b)フィギュアスケート選手はスケート靴の接地面積が小さいために氷の上に大きな圧力をかけています。(credit a: modification of work by Guido da Rozze; credit b: modification of work by Ryosuke Yagi)
圧力のSI単位はパスカル(Pa)で、1 Pa = 1 N/m²です。ここで、Nはニュートンであり、1 kg m/s²として定義される力の単位です。1パスカルは小さな圧力です。多くの場合、キロパスカル(1 kPa = 1000 Pa)やバール(1 bar = 100,000 Pa)の単位を使う方がより便利です。米国では、圧力(たとえば、車のタイヤ)はしばしば、1平方インチの面積にかかる力のポンド(1平方インチあたりポンド:psi)で測定されます。圧力は気圧の単位(atm)を使って測定されることもあります。この単位はもともとパリのおおよその緯度(45°)における平均海面気圧を表していました。表9.1は、圧力測定のためのこれらの単位といくつかの他の一般的な単位についての情報を提供しています。
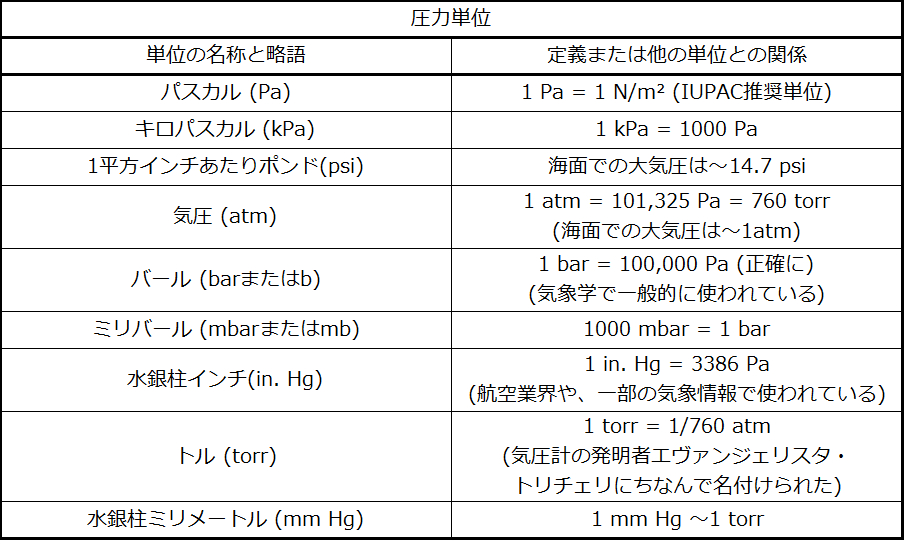
表9.1
例題9.1 圧力単位の変換
アメリカ国立気象局は、圧力を水銀柱インチとミリバールの両方で報告しています。29.2in. Hgの圧力を以下のものに換算してください:
(a)torr
(b)atm
(c)kPa
(d)mbar
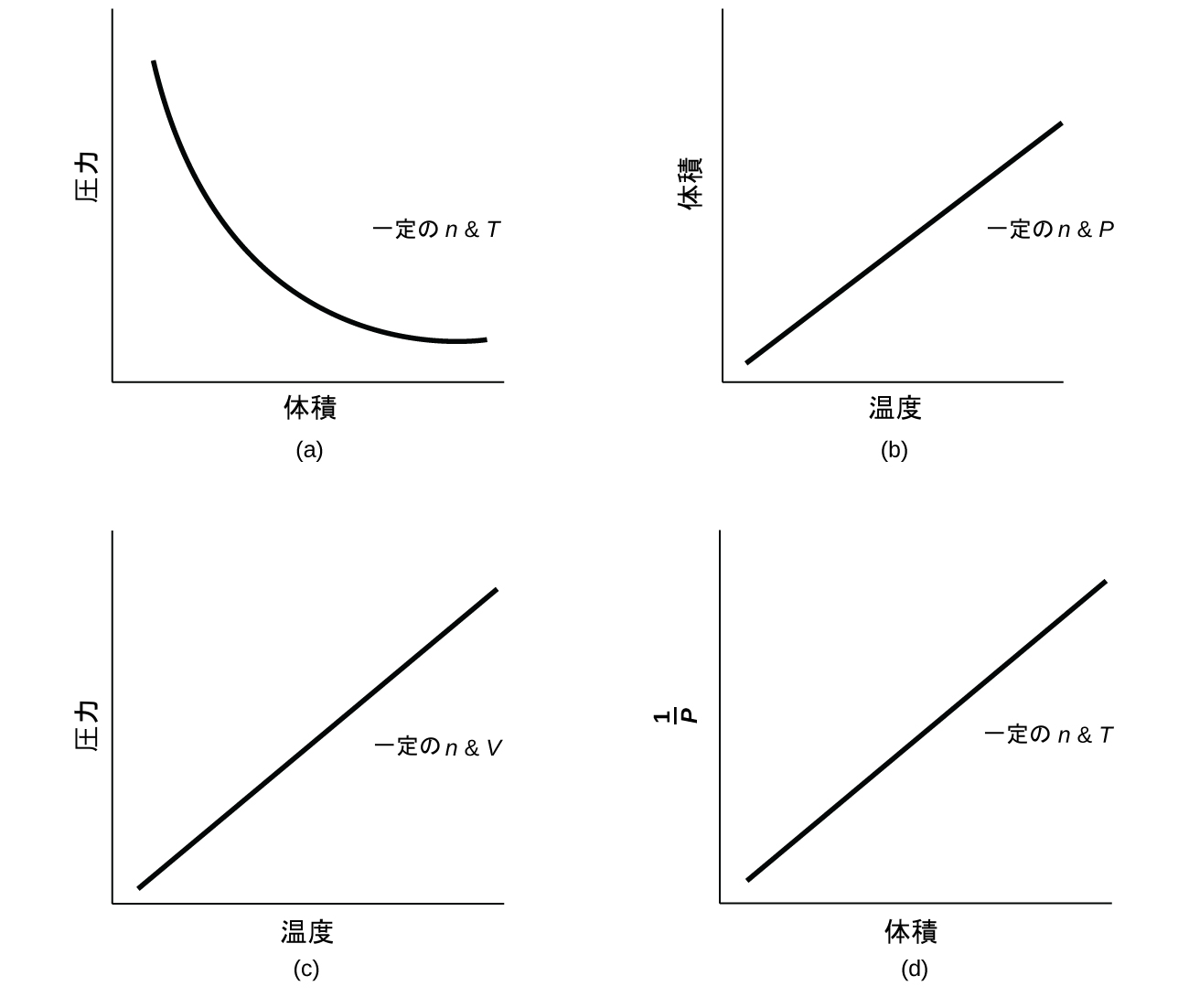
解法
これは単位変換の問題です。さまざまな圧力単位の間の関係性は表9.1に与えられています。
\(\rm (a)\ 29.2\ in.Hg ×\frac{25.4\ mm}{1\ in}×\frac{1\ torr}{1\ mm Hg}= 742\ torr\)
\(\rm (b)\ 742\ torr ×\frac{1\ atm}{760\ torr}= 0.976\ atm\)
\(\rm (c)\ 742\ torr ×\frac{101.325\ kPa}{760\ torr}= 98.9\ kPa\)
\(\rm (d)\ 98.9\ kPa ×\frac{1000\ Pa}{1\ kPa}×\frac{1\ bar}{100,000\ Pa}×\frac{1000\ mbar}{1\ bar}= 989\ mbar\)
学習内容の確認
カンザスシティーの典型的な大気圧は740torrです。この大気圧は、気圧、水銀柱ミリメートル、キロパスカル、バールでは何ですか?
解答:0.974 atm、740 mm Hg、98.7 kPa、0.987 bar
私たちは気圧計を使って、大気が地表に及ぼす力である大気圧を測定することができます(図9.4)。気圧計とは、一端を閉じたガラス管の中に水銀などの不揮発性の液体を入れ、それを逆さにして同じ液体を入れた容器の中に浸したものです。大気が管の外側の液体に圧力をかけ、管の内側では液体の柱が圧力をかけます。管の内側と外側では液面の圧力が同じです。したがって、管内の液体の高さは、大気が及ぼす圧力に比例します。
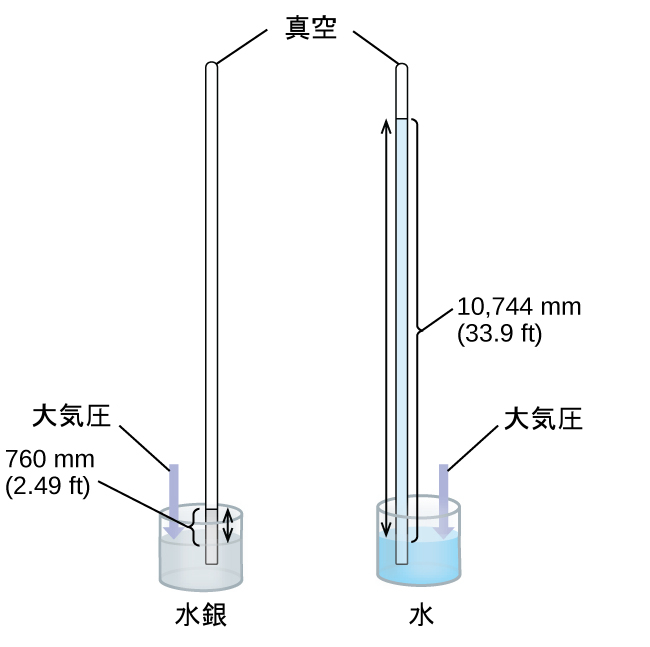
図9.4 | 気圧計では、液体の柱の高さhを大気圧の測定値として使用します。水(右側)を使用すると気圧計の高さは30フィート以上が必要になるのに対し、非常に密度の高い液体水銀(左側)を使用すると、妥当な大きさの気圧計を作ることが可能になります。
液体が水である場合、通常の大気圧は高さ10メートルを超える水の柱を支えることができます。これは気圧計を作る(そして読み取る)にはひどく不便です。水銀(Hg)は水の約13.6倍の密度であるため、水銀の気圧計は、水の気圧計の1/13.6の高さしか必要とせず、気圧計としてより適したサイズとすることができます。海面での1気圧(101,325 Pa)の標準的な大気圧は、高さ約760 mm(29.92インチ)の水銀柱に相当します。torrはもともと1水銀柱ミリメートルに相当する単位でしたが、現在では正確には対応していません。重力によって流体にかかる圧力は、静水圧pとして知られています:
\[ p = hρg \]
ここで、hは流体の高さ、ρは流体の密度、gは重力による加速度です。
例題9.2 大気圧の計算
海面付近の大気圧が約760mmの高さの水銀柱によって及ぼされる圧力に対応しているという主張を支持する計算を示してください。水銀の密度は13.6 g/cm³です。
解法
静水圧は、p = hρg で与えられます。h = 760 mm、ρ = 13.6 g/cm³、g = 9.81 m/s² です。これらの値を式にはめ込み、必要な単位変換を行うと、求める値が得られます。(注:私たちは およそ101,325 Paという圧力を予測しています。)
\[ \begin{array}{ll} 101,325\ N\rm /m^2 = 101,325\frac{kg·m/s^2}{m^2}= 101,325\frac{kg}{m·s^2}\\ p ={\rm \left(760\ mm×\frac{1\ m}{1000\ mm}\right)×\left(\frac{13.6\ g}{1\ cm^3}×\frac{1\ kg}{1000\ g}×\frac{(100\ cm)^3}{(1\ m)^3}\right)×\left(\frac{9.81\ m}{1\ s^2}\right)}\\ = \rm (0.760\ m)(13,600\ kg/m^3)(9.81\ m/s^2)\\ = \rm 1.01 × 10^5\ kg/ms^2\\ = 1.01 × 10^5\ N\rm /m^2\\ = \rm 1.01 × 10^5\ Pa\\ \end{array} \]
学習内容の確認
通常の大気圧に相当する25°Cの水の柱の高さを計算してください。この温度での水の密度は1.0 g/cm³です。
解答:10.3 m
マノメーターは、容器に閉じ込められた気体の圧力を測定するために使用される、気圧計に似た装置です。端部閉鎖型マノメーターは、端部が閉じられた1つのアーム、測定される気体に接続する1つのアーム、および、その間に不揮発性の液体(通常は水銀)を備えたU字型の管です。気圧計と同様に、管の2つのアーム内の液面間の距離(図中のh)は、容器内の気体の圧力に比例します。端部開放型マノメーター(図9.5)は端部閉鎖型マノメーターと同じですが、片方のアームが大気に向けて開放されています。この場合、液面間の距離は、容器内の気体と大気との間の圧力差に対応します。
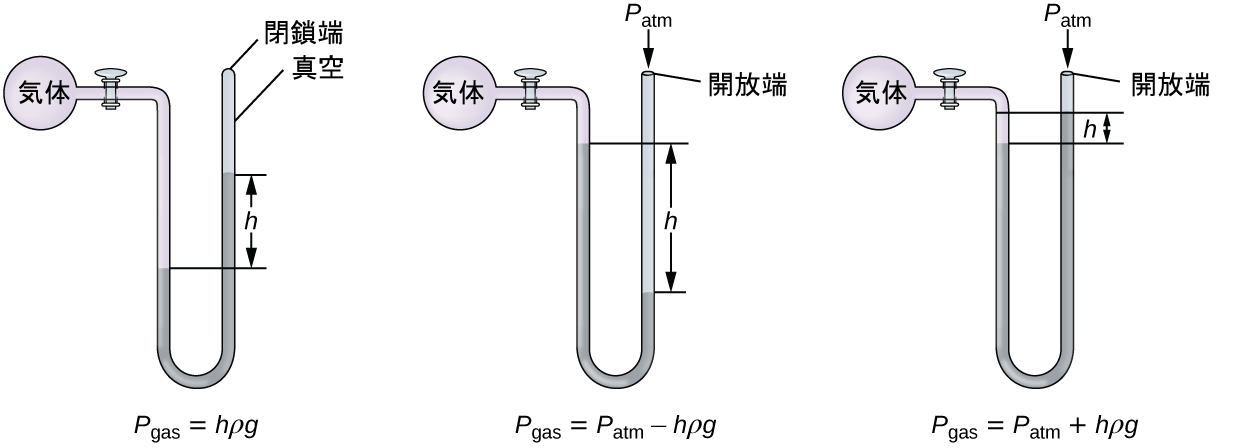
図9.5 | マノメーターを使って気体の圧力を測定することができます。液面の間の高さ(の差)(h)が圧力の指標となります。水銀は密度が大きいので、通常は水銀が使われます。
例題9.3 端部閉鎖型マノメーターを用いた圧力の計算
気体の試料の圧力を、端部閉鎖型マノメーター(右部分に示されているように)を使って測定します。マノメーターの中の液体は水銀です。気体の圧力を以下の単位で求めてください:
(a)torr
(b)Pa
(c)bar
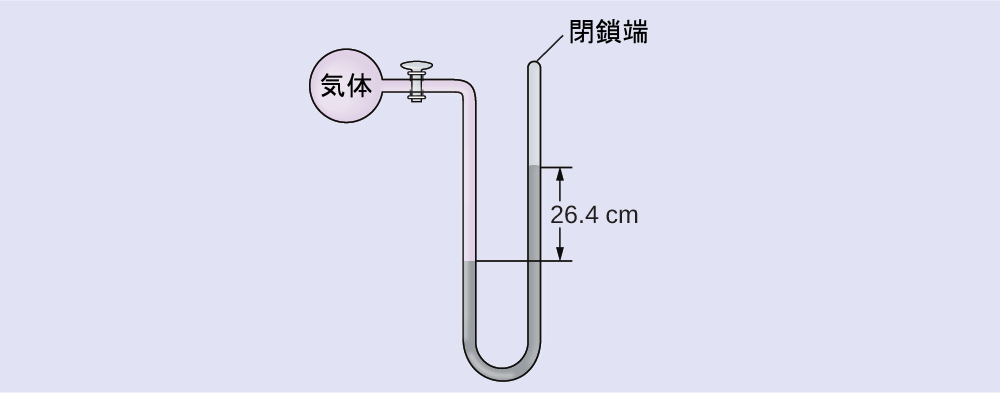
解法
気体の圧力は、高さ26.4cmの水銀柱に等しいです。(管の両側において、2本の水平線のうちの下のものの場所での圧力が等しくなっています。左側の圧力は気体によるもので、右側の圧力は26.4cmの水銀によるものです。)例題9.2のようにp = hρgという式を使うこともできますが、表9.1を使って単位間で変換するだけの方が簡単です。
\(\rm (a)\ 26.4\ cm Hg ×\frac{10\ mm Hg}{1\ cm Hg}×\frac{1\ torr}{1\ mm Hg}= 264\ torr\)
\(\rm (b)\ 264\ torr ×\frac{1\ atm}{760\ torr}×\frac{101,325\ Pa}{1\ atm}= 35,200\ Pa\)
\(\rm (c)\ 35,200\ Pa ×\frac{1\ bar}{100,000\ Pa}= 0.352\ bar\)
学習内容の確認
気体の試料の圧力を端部閉鎖型マノメーターで測定します。マノメーターの中の液体は水銀です。気体の圧力を以下の単位で求めてください:
(a)torr
(b)Pa
(c)bar
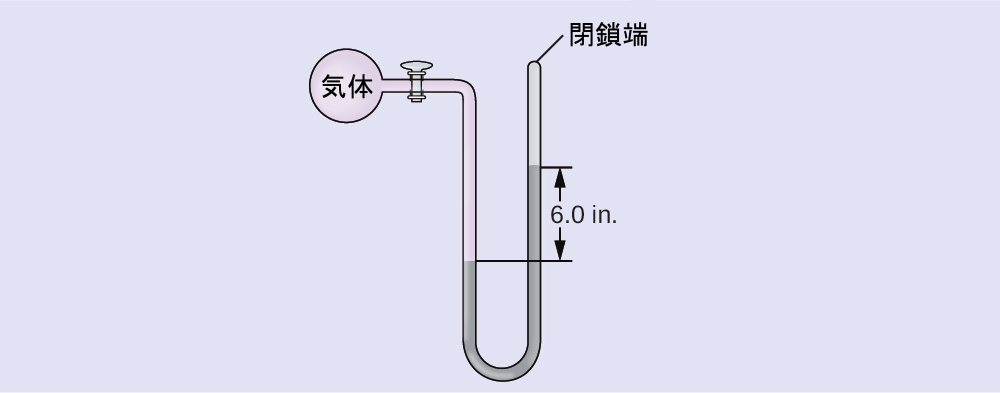
解答:(a)~150 torr、(b)~20,000 Pa、(c)~0.20 bar
例題9.4 端部開放型マノメーターを用いた圧力の計算
海面での気体の試料の圧力を、端部開放型Hg(水銀)マノメーター(右部分に示されているように)を使って測定します。気体の圧力を以下の単位で求めてください:
(a)mm Hg
(b)atm
(c)kPa
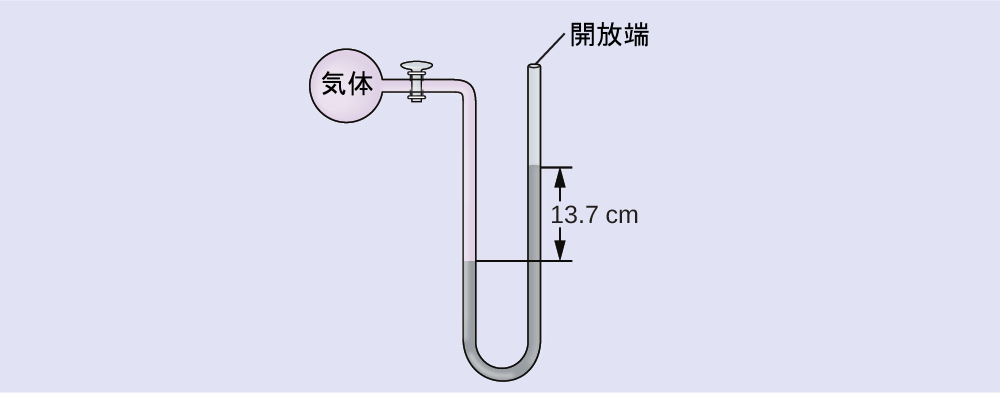
解法
気体の圧力は、高さ13.7cmの水銀柱による静水圧に海面の大気の圧力を加えたものに等しいです。(管の両側において、2本の水平線のうちの下のものの場所での圧力が等しくなっています。左側の圧力は気体によるもので、右側の圧力は13.7cmのHgに大気圧を加えたものによるものです。)
\(\rm (a)\ mm Hgでは、このようになります: 137\ mm Hg + 760\ mm Hg = 897\ mm Hg\)
\(\rm (b)\ 897\ mm Hg ×\frac{1\ atm}{760\ mm Hg}= 1.18\ atm\)
\(\rm (c)\ 1.18\ atm ×\frac{101.325\ kPa}{1\ atm}= 1.20 × 10^2\ kPa\)
学習内容の確認
海面での気体の試料の圧力を、端部開放型Hgマノメーター(右部分に示されているように)を使って測定します。気体の圧力を以下の単位で求めてください:
(a)mm Hg
(b)atm
(c)kPa
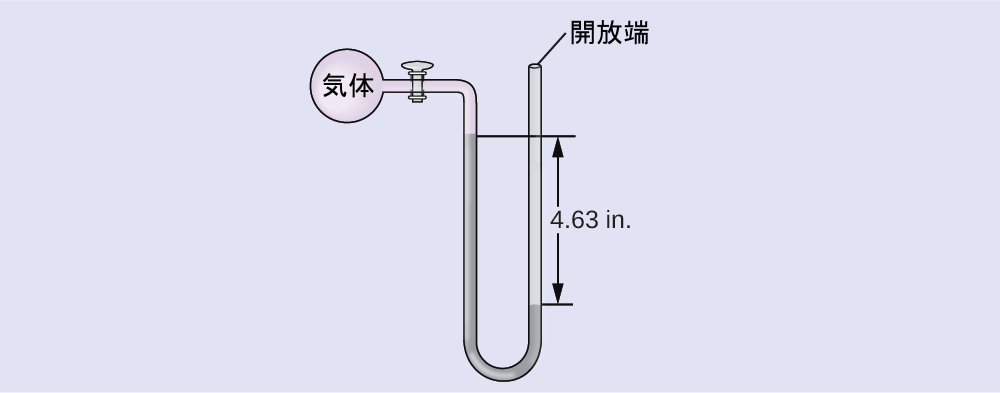
解答:(a)642 mm Hg、(b)0.845 atm、(c)85.6 kPa
日常生活の中の化学
血圧を測定する
血圧は、血圧計(sphygmomanometer:ギリシャ語のsphygmosは「脈」を意味します)と呼ばれる装置を用いて測定します。それは、血流を制限するために腕に巻く膨張式バンド、圧力を測定するマノメーター、および、血流がいつ開始し、いつ阻害されたかを判定する方法からなります(図9.6)。血圧計は、1881年に発明されて以来、医療に欠かせない機器となっています。血圧計には、聴診器が必要で医療専門家によって使用される手動式のもの、正確さが要求される場合に使用する水銀式のもの、正確さの低い機械式のもの、少ない訓練で使用できるが限界があるデジタル式のものなど、多くの種類があります。血圧計を使用する場合、バンドが上腕の周りに巻かれ、血流が完全に遮断されるまで膨らまされて、その後ゆっくりと空気が抜かれていきます。心臓が鼓動すると、動脈を通り抜けようとする血液が圧力の上昇を引き起こします。血流が始まる点での圧力の上昇が収縮期血圧であり、これが心周期のピーク圧力となります。バンドの圧力が動脈の収縮期血圧と等しくなると、血液がバンドを通過し、聴診器を使って聞こえる音を発生させます。その後、心臓の心室が次の拍動に備えるにつれて圧力が低下します。バンドの圧力が低下し続けると、最終的に音が聞こえなくなります。これが拡張期血圧であり、心周期の中で最も低い圧力(休止期)です。血圧計の血圧の単位は水銀柱ミリメートル(mm Hg)です。

図9.6 | (a)血圧計で患者の血圧を測定する準備をする医療技術者。(b)典型的な血圧計は、バンドを膨らませるために弁の付いたゴム球を使用し、圧力を測定するためにダイアフラムゲージを使用します。(credit a: modification of work by Master Sgt. Jeffrey Allen)
さまざまな科学のつながり
気象学・気候学・大気科学
さまざまな時代を通じて、人々は雲や風、降水量などを観察し、パターンを見極め、予測を立てようとしてきました:作物を植えたり、収穫したりするのはいつが最適なのか、海洋航海に漕ぎ出すのが安全か否か、などです。私たちは現在、文明や生態系に大きな影響を与える複雑な気象・大気関連の課題に直面しています。いくつかの異なる科学分野では、気象、大気、気候をよりよく理解するのに役立てるために、化学的な原理を用いています。気象学、気候学、大気科学といったものがあります。気象学は、大気、大気現象、大気が地球の気象に与える影響を研究する学問です。気象学者は、短期的に気象を理解し、予測することで、人命を救い、経済に利益をもたらすことを目指しています。天気予報(図9.7)は、世界中の気象センターで、何千もの気圧や気温などの測定値をまとめ、モデル化し、分析したものの結果です。
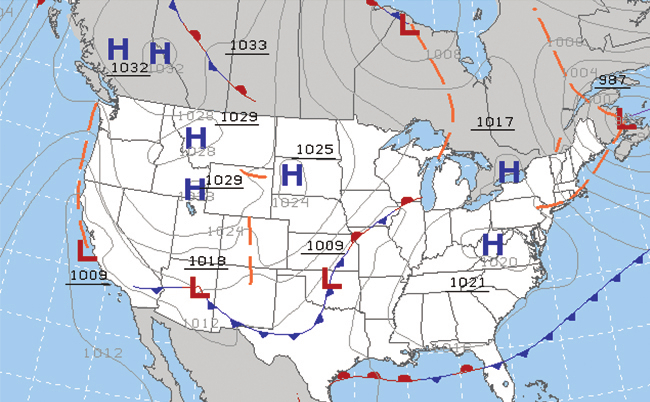
図9.7 | 気象学者は天気図を使って気象を表現し、予測しています。気圧の高い(H)領域と低い(L)領域は、気象条件に大きな影響を与えます。灰色の線は等圧線として知られる一定の気圧の位置を表しています。(credit: modification of work by National Oceanic and Atmospheric Administration)
気象学的には、地表の気圧が周囲の環境よりも低いときに低気圧が発生します:湿った空気が上昇して凝縮し、雲が生じます。さまざまな気象前線の中での水分や空気の動きが、ほとんどの気象の事象を引き起こします。
大気は、惑星を取り囲んでいる気体の層です。地球の大気の厚さは約100~125kmで、おおまかに窒素78.1%、酸素21.0%で構成されており、さらに図9.8に示されるようにいくつかの領域に細分化されています:外気圏(地球から最も遠い、海面の上700kmより高い場所)、熱圏(80~700km)、中間圏(50~80km)、成層圏(大気の中で2番目に低い、海面の上12~50km)、および対流圏(海面の上12kmまでで、地球の大気の約80%の質量を占め、ほとんどの気象現象が発生する層)に分けられます。対流圏を上に行くほど、大気の密度や温度は低下していきます。
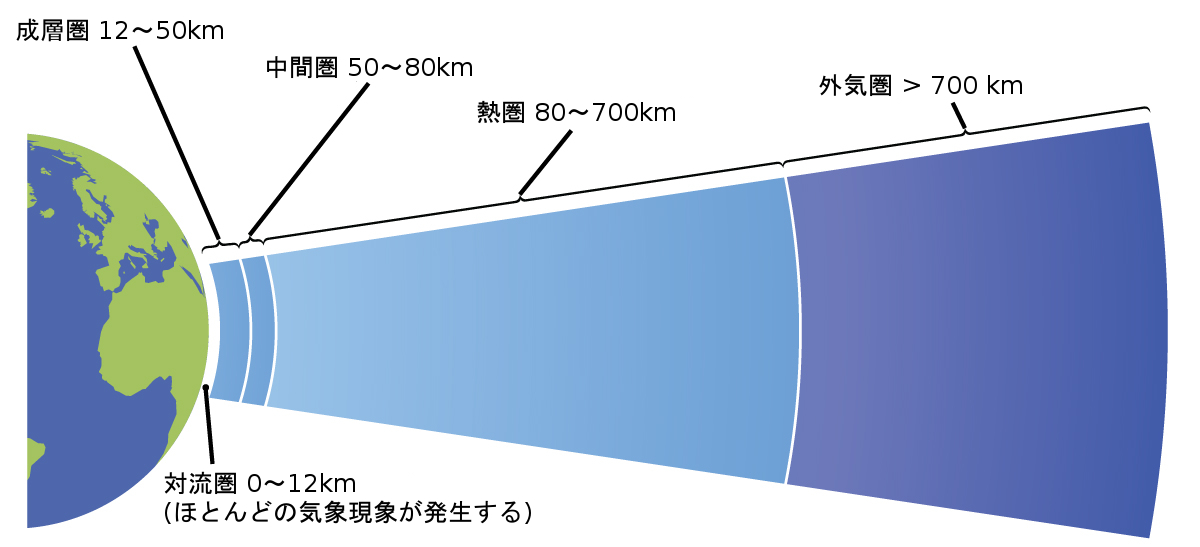
図9.8 | 地球の大気は、対流圏、成層圏、中間圏、熱圏、外気圏の5つの層で構成されています。
気候学とは、大気のデータを用いて気候(長期的に平均化された気象状況)を研究する学問です。しかしながら、気候学者は、気象学者のように数時間、数日、数週間という短い時間枠ではなく、何十年、何世紀、何千年にもわたって起こるパターンや影響を研究しています。大気科学は、気象学、気候学、および大気を研究する他の科学分野を組み合わせた、より広い分野です。
9.2 圧力、体積、量、および温度を関係付ける:理想気体の法則
この節が終わるまでに、あなたは次のことができるようになります:
•気体のさまざまな性質の間の数学的関係を特定する
•理想気体の法則と関連する気体の法則を使用して、特定の条件下でさまざまな気体の性質の値を計算する
17世紀から特に18世紀にかけて、自然を理解したいという願望と、空を飛ぶことができる気球を作りたいという探求の両方に駆り立てられて(図9.9)、多くの科学者が気体の巨視的な物理的性質、すなわち気体の圧力、体積、温度、量の間の関係性を確立しました。彼らの測定は、今日の基準からすれば正確なものではありませんでしたが、彼らはこれらの変数のペア(たとえば、圧力と温度、圧力と体積)の間の数学的な関係を決定することができました。それらは、理想気体(所定の条件下では現実の気体を近似するような仮説的な構築物)について成り立つようなものでした。最終的に、これらの個々の法則は1つの方程式、すなわち理想気体の法則へとまとめられました。それは、さまざまな気体についての気体量を関連付けることができ、低い圧力と中程度の温度に対して非常に正確です。私たちは、個々の関係における重要な展開を考察し(教育上の理由から歴史的な順序通りではありませんが)、その後でそれらを理想気体の法則にまとめていきます。

図9.9 | 1783年、最初の(a)水素充填気球飛行、(b)有人の熱気球飛行、(c)有人の水素充填気球飛行が行われました。(a)に描かれている水素充填気球が着陸すると、怯えたゴネスの村人たちは熊手やナイフで気球を破壊したと言われています。後者の飛行はパリで40万人が見たと言われています。
圧力と温度:アモントンの法則
圧力計が取り付けられた頑丈な容器に気体を充填し、気体が逃げないように容器を密閉したところを想像してみてください。もし容器を冷やすと、中の気体も同様に冷たくなり、圧力が下がるのが観測されます。容器が頑丈で密閉されているので、気体の体積もモル数も一定です。もし私たちがこの容器を加熱すると、内部の気体が高温になり(図9.10)、圧力が上昇します。
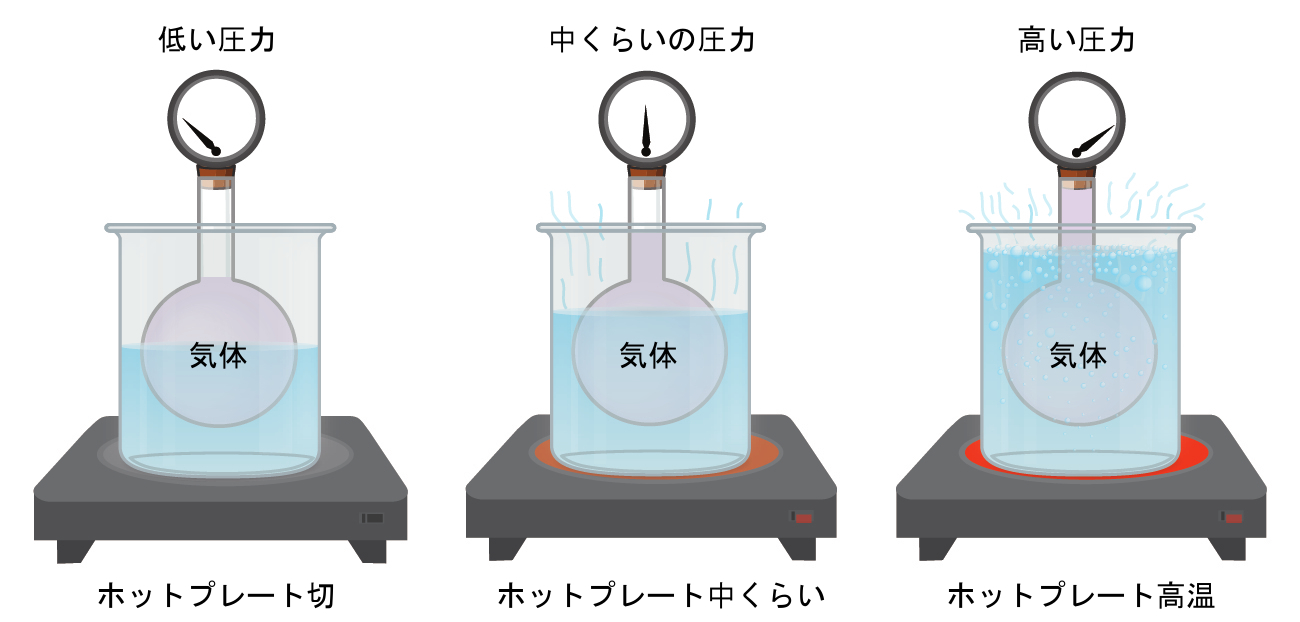
図9.10 | 温度が気体の圧力に与える影響:ホットプレートがオフの状態では、球体の中の気体の圧力は比較的低いです。気体が加熱されると、球体の中の気体の圧力は上昇します。
このような温度と圧力の関係は、一定の体積に閉じ込められた気体のどのような試料に対しても観察されます。それらの条件下にある空気の試料について、実験的な圧力-温度データの例が図9.11に示されています。私たちは、温度と圧力は直線的に関係しており、温度がケルビンスケールであればPとTは正比例する、ということがわかります(やはり、気体の体積とモル数が一定であるときには)。もしケルビンスケールの温度が一定の倍数で上昇すると、気体の圧力も同じ倍数で上昇します。
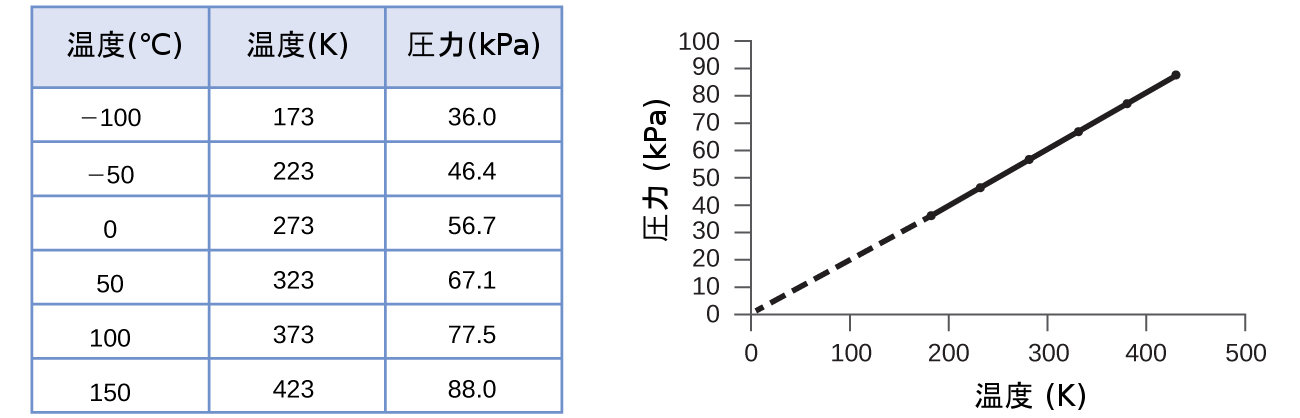
図9.11 | 空気の体積と量が一定の場合、温度がケルビン単位であれば、圧力と温度は正比例します。(低温では、気体の凝縮のため測定ができません。)この線をより低い圧力のほうに外挿していくと、-273°Cで圧力が0になります。そこはケルビンスケールの0であり、絶対零度と呼ばれる可能な限り最低の温度です。
気体の圧力と温度の間の関係性を経験的に確立したのはギヨーム・アモントンが最初で(~1700年)、ジョセフ・ルイ・ゲイ-リュサックがその関係性をより正確に決定しました(~1800年)。このため、気体のP-T関係は、アモントンの法則またはゲイ-リュサックの法則として知られています。いずれの名前であっても、それは、体積が一定に保持されている場合、所与の量の気体の圧力は、ケルビンスケールでの温度に正比例している、ということを述べています。数学的には、これは以下のように書くことができます:
\[ P ∝ T\\または\ P = 定数× T\\または\ P = k × T \]
ここで、∝は「比例している」という意味であり、kは気体の種類、量、体積に依存する比例定数です。
したがって、閉じ込められた一定の体積の気体の場合、比率P/Tは一定です(すなわち、P/T = k)。もし気体が最初は「条件1」(P = P₁、T = T₁)であり、その後「条件2」(P = P₂、T = T₂)に変化したとすると、P₁/T₁ = k、P₂/T₂ = kとなり、P₁/T₁ = P₂/T₂とまとめられます。この式は、閉じ込められた一定の体積の気体についての圧力-温度計算に役立ちます。どのような気体の法則の計算であっても、温度はケルビンスケールでなければならないことに注意してください(ケルビンスケールで0、可能な限り最低の温度は絶対零度と呼ばれます)。(また、気体の圧力が温度の変化に伴ってどのように変化するかを記述する方法が少なくとも3つあることに注意してください:私たちは値の表、グラフ、または数式を使うことができます。)
例題9.5 温度による圧力の変化を予測する
ヘアスプレーの缶は、噴霧剤であるイソブタン気体以外が空になるまで使用します。
(a)缶には「120°F (48.8 °C)以下の温度でのみ保管してください。焼却しないでください。」と警告がされています。なぜですか?
(b)缶の中の気体の初期温度は24°C、360kPaで、缶の体積は350mLです。もし暑い日に50°Cに達した車内に缶を放置した場合、缶内の新しい圧力はどれだけになるでしょうか?
解法
(a)缶の中にはある量のイソブタン気体が一定の体積で入っているので、加熱によって温度が上がれば、それに比例して圧力も上がります。温度が高いと圧力が高くなり、缶が破裂する恐れがあります。(また、イソブタンは可燃性のため、焼却すると爆発を引き起こします。)
(b)私たちは、一定の体積での温度変化による圧力変化を求めているので、アモントンの法則/ゲイ-リュサックの法則を使います。P₁とT₁を初期値、T₂を圧力が未知の温度、P₂を未知の圧力とし、°CをKに換算すると、以下のようになります:
\[ \frac{P_1}{T_1}=\frac{P_2}{T_2}すなわち{\rm \frac{360\ kPa}{297\ K}=}\frac{P_2}{\rm 323\ K}\\ \]
並べ替えて解くと、以下のようになります:
\[ P_2 =\rm \frac{360\ kPa × 323\ K}{297\ K}= 390\ kPa \]
学習内容の確認
窒素(N₂)の試料は、27 °C、600 torrで45.0 mLの体積を占めています。体積が一定の状態で-73°Cまで冷却した場合の圧力はどれだけになるでしょうか?
解答:400 torr
体積と温度:シャルルの法則
もし私たちが風船に空気を入れて密封すると、風船の中には大気圧で、たとえば1atmで特定の量の空気が入っていることになります。この風船を冷蔵庫に入れると、中の気体が冷たくなって風船が縮んでしまいます(気体の量も圧力も一定であるにもかかわらず)。もし風船を極低温にするとさらに縮み、温めるとまた膨らみます。
学習へのリンク
このビデオ(http://openstaxcollege.org/l/16CharlesLaw)は、気体を冷却したり加熱したりすると、気体の体積がそれぞれ減少したり増加したりすることを示しています。
一定の圧力で一定の量の閉じ込められた気体の体積に対する温度の影響を示すこれらの例は、一般的に成り立ちます:温度が上がると体積は増加し、温度が下がると体積は減少します。1モルのメタン気体の試料について、1atmでの体積-温度データが図9.12に示されています。
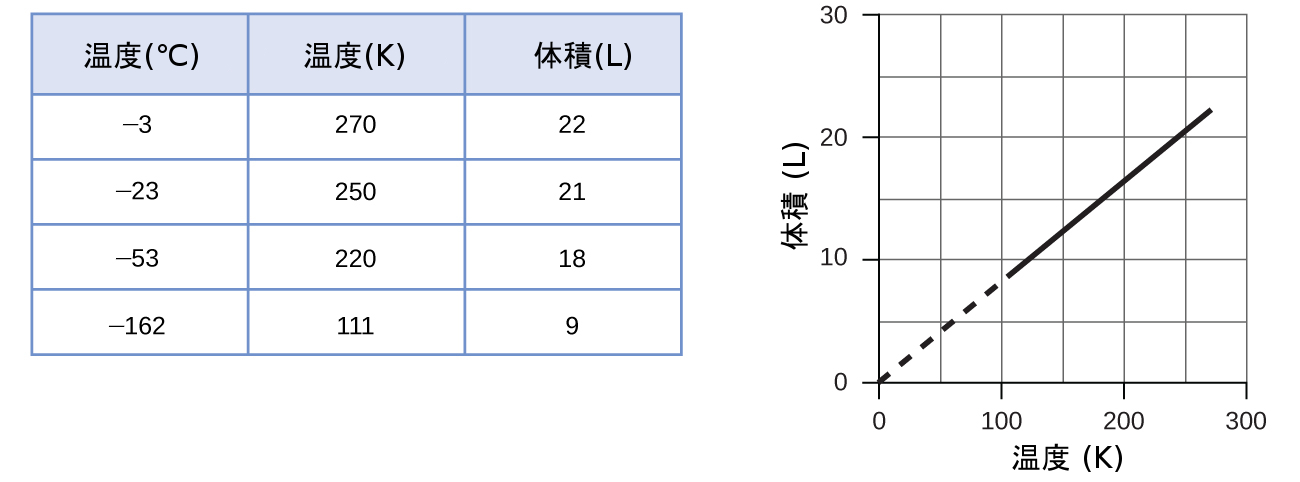
図9.12 | 1atmの一定圧力で1モルのメタン気体の体積と温度は、線形関係にあります。もし温度がケルビンの場合、体積と温度は正比例します。直線は111Kで止まっていますが、これはメタンがこの温度で液化するためです。外挿するとグラフの原点(絶対零度)と交差します。
一定圧力で所与の量の気体における体積と温度の間の関係性は、フランス人の科学者で気球飛行の先駆者であるジャック・アレクサンドル・セザール・シャルルにちなんで、シャルルの法則として知られています。シャルルの法則は、圧力を一定に保つと、ある所与の量の気体の体積は、そのケルビンスケールでの温度に正比例することを述べています。
数学的には、これは以下のように書くことができます:
\[ V ∝ T\\または\ V = 定数×T\\または\ V = k×T\\または\ \frac{V_1}{T_1} = \frac{V_2}{T_2} \]
ここで、kは気体の量と圧力に依存する比例定数です。
閉じ込められた一定圧力の気体の試料では、V/Tは一定であり(すなわち、比率 = k)、P-T関係で見られるように、これはシャルルの法則の別の形を導き出します:
\[ \frac{V_1}{T_1} = \frac{V_2}{T_2} \]
例題9.6 温度による体積の変化を予測する
二酸化炭素(CO₂)の試料は、10 °C、750 torrで0.300 Lの体積を占めています。この気体が30 °C、750 torrであるときの体積は何ですか?
解法
私たちは一定圧力での温度の変化による体積の変化を求めているので、これはシャルルの法則の出番です。V₁とT₁を初期値、T₂を体積が未知の温度、V₂を未知の体積とし、°CをKに換算すると以下のようになります:
\[ \frac{V_1}{T_1}=\frac{V_2}{T_2}すなわち\frac{\rm 0.300\ L}{\rm 283\ K}=\frac{V_2}{\rm 303\ K} \]
並べ替えて解くと、以下のようになります:
\[ V_2 =\frac{\rm 0.300\ L× 303\ K}{\rm 283\ K}= \rm 0.321\ L \]
この答えは、シャルルの法則からの予想、つまり、一定の圧力で気体の温度を(283Kから303Kに)上げると、気体の体積が(0.300Lから0.321Lに)増加するだろうということを支持します。
学習内容の確認
酸素(O₂)の試料は、30 °C、452 torrで32.2 mLの体積を占めています。圧力が同じで-70°Cの場合には、体積は何になりますか?
解答:21.6 mL
例題9.7 体積の変化で温度を測定する
温度は、気体温度計を用いて、一定圧力での温度変化に伴う気体の体積の変化を観察することにより測定することがあります。ある水素気体温度計の中の水素は、氷と水の混合液(0.00°C)に浸したときは体積が150.0cm³です。沸騰している液体アンモニアに浸した場合、同じ圧力で水素の体積は131.7 cm³となりました。沸騰しているアンモニアの温度をケルビンと摂氏で求めてください。
解法
一定圧力での温度の変化による体積の変化であるので、私たちはシャルルの法則を使うべきです。V₁とT₁を初期値、T₂を未知の温度、V₂を温度が未知の体積とし、°CをKに換算すると以下のようになります:
\[ \frac{V_1}{T_1}=\frac{V_2}{T_2}すなわち\frac{\rm 150.0\ cm^3}{\rm 273.15\ K}=\frac{\rm 131.7\ cm^3}{T_2} \]
並べ替えると
\[ T_2 =\frac{\rm 131.7\ cm^3 × 273.15\ K}{\rm 150.0\ cm^3}= \rm 239.8\ K \]
239.8Kから273.15を引くと、沸騰しているアンモニアの温度は摂氏スケールで-33.4°Cであることがわかります。
学習内容の確認
エタンの試料が298 K、1.1 atmで405 mLの体積を占めている場合、467 K、1.1 atmでのこの試料の体積は何ですか?
解答:635 mL
体積と圧力:ボイルの法則
気密性の高いシリンジに部分的に空気を入れると、シリンジには一定の温度、たとえば25°Cで特定の量の空気が入っていることになります。もし私たちが温度を一定に保ったままプランジャーをゆっくりと押し込むと、シリンジ内の気体は圧縮されて体積が小さくなり、圧力が上昇します。プランジャーを引き抜くと、体積が大きくなり圧力が低下します。この例のような、所与の量の閉じ込められた気体の圧力に対する体積の影響は、一般的に当てはまります。閉じ込められた気体の体積を減らせば圧力が上がり、体積を増やせば圧力が下がります。実際には、体積がある一定の割合で増加すれば、圧力は同じ割合で減少し、その逆もまた同様です。常温の空気の試料の体積-圧力データが図9.13にグラフで示されています。
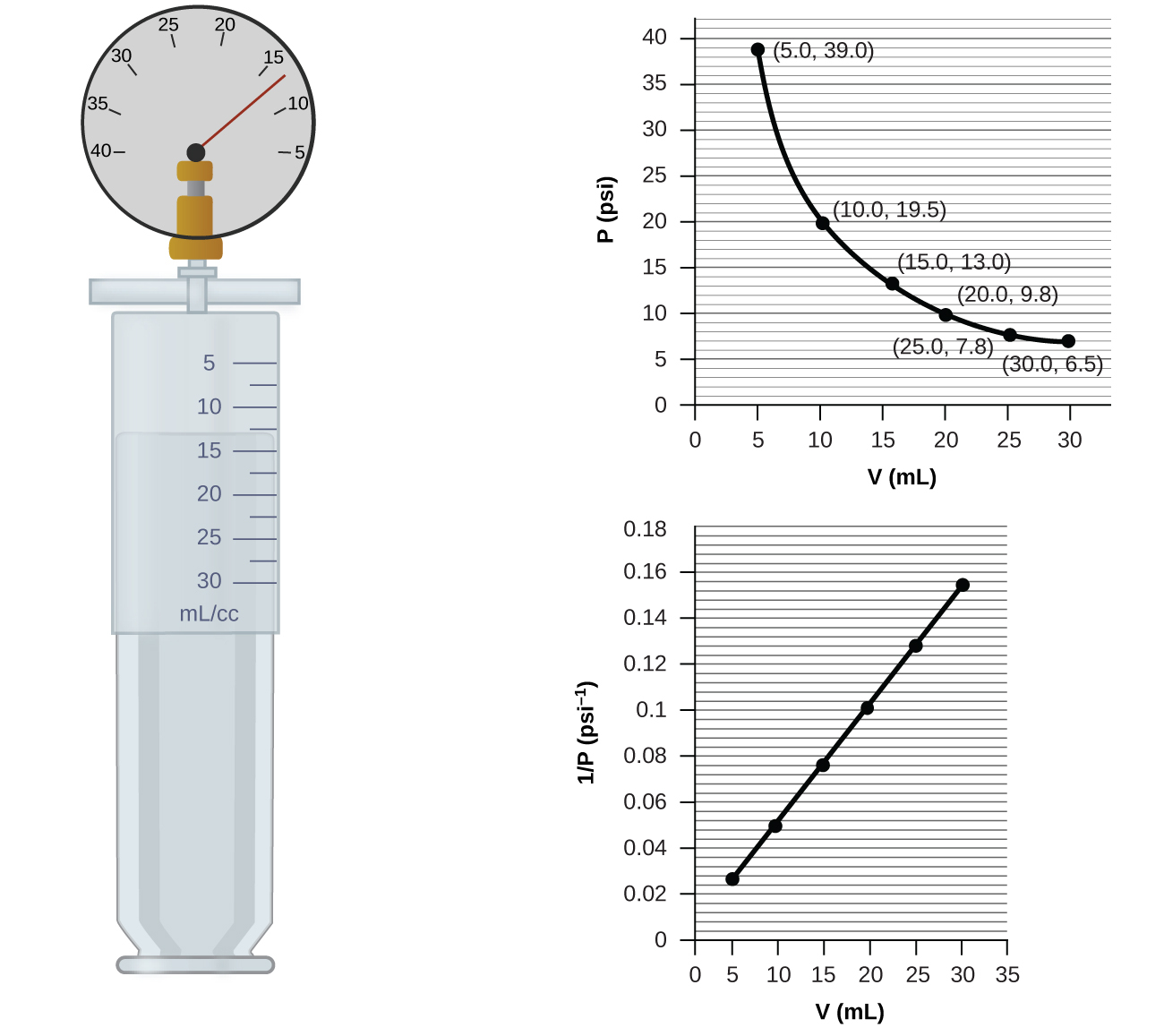
図9.13 | 気体が小さな体積を占めるようになると圧力が高くなり、大きな体積を占めるようになると圧力が低くなります(気体の量と温度が変わらないと仮定して)。PとVは反比例するので、1/PとVとのグラフは直線になります。
P-T関係やV-T関係とは異なり、圧力と体積は互いに正比例するわけではありません。そうではなくて、PとVは反比例を示します:圧力を上げると気体の体積が減少することになります。数学的には、これは以下のように書くことができます:
\[ P∝\frac{1}{V}\\または\ P = k×\frac{1}{V}\\または\ P×V = k\\または\ P_1 V_1 = P_2 V_2 \]
ここで、kは定数です。グラフとしては、この関係は、圧力の逆数(1/P)と体積(V)、または体積の逆数(1/V)と圧力(P)をプロットしたときに得られる直線によって示されます。曲線のグラフは、変数の値が低い場合や高い場合に正確に読み取るのが難しく、理論式やパラメータを実験データにフィッティングする際に使用するのはさらに難しいです。このような理由から、科学者はしばしばデータを「線形化」する方法を見つけようとします。もし私たちがPとVをプロットするならば、双曲線が得られます(図9.14参照)。
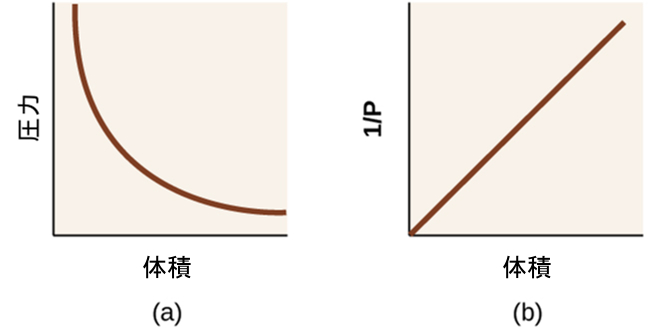
図9.14 | 圧力と体積の関係性は反比例です。(a)PとVのグラフは双曲線であるのに対し、(b)(1/P)とVのグラフは直線です。
一定温度で所与の量の気体における体積と圧力の間の関係性は、300年以上前にイングランドの自然哲学者ロバート・ボイルによって初めて発表されました。それは、現在ではボイルの法則として知られている文に要約されています:一定温度で所与の量の気体の体積は、それを測定する圧力に反比例します。
例題9.8 気体の試料の体積
図9.13での気体の試料が、13.0psiの圧力で15.0 mLの体積を有しています。この気体が7.5 mL の体積を有しているときの圧力を、以下のものを用いて決定してください。
(a)図9.13のP-Vグラフ
(b)図9.13の1/PとVのグラフ
(c)ボイルの法則の式
それぞれの方法がどの程度正確であるかについてコメントしてください。
解法
(a)P-Vグラフから推定すると、Pの値は27psiの近くにあります。
(b)1/PとVのグラフから推定すると、約 26 psiという値が得られます。
(c)ボイルの法則から、一定の温度での所与の気体の試料の圧力と体積の積(PV)は常に同じ値になることがわかります。したがって、P₁V₁ = k、P₂V₂ = k となり、P₁V₁ = P₂V₂となります。
P₁とV₁を既知の値 13.0 psi と 15.0 mLとし、P₂を未知の圧力、V₂を圧力が未知の体積とすると、以下のようになります:
\[ P_1 V_1 = P_2 V_2\\{\rm 13.0\ psi × 15.0\ mL} = P_2 × {\rm 7.5\ mL} \]
これを解くと:
\[ P_2 =\frac{\rm 13.0\ psi × 15.0\ mL}{\rm 7.5\ mL}= \rm 26\ psi \]
P-Vグラフからうまく推定するのはより難しかったので、(b)や(c)よりも(a)の方が不正確である可能性が高いです。計算は式と測定値が許す限り正確なものになるでしょう。
学習内容の確認
図9.13での気体の試料が、6.5psiの圧力で30.0 mLの体積を有しています。この気体が11.0 psiの圧力を有しているときの体積を、以下のものを用いて決定してください。
(a)図9.13のP-Vグラフ
(b)図9.13の1/PとVのグラフ
(c)ボイルの法則の式
それぞれの方法がどの程度正確であるかについてコメントしてください。
解答:(a)約17~18 mL、(b)~18 mL、(c)17.7 mL。P-Vグラフからうまく推定するのはより難しかったので、(b)よりも(a)の方が不正確である可能性が高いです。計算は式と測定値が許す限り正確なものになるでしょう。
日常生活の中の化学
呼吸とボイルの法則
あなたが一生の間、1分間に約20回、休むことなく、多くの場合、意識することなく行っていることは何でしょうか?その答えは、もちろん息、つまり呼吸です。それはどのようにして行われているのでしょうか?ここでは気体の法則が適用されていることがわかります。あなたの肺は体が必要とする気体(酸素)を取り込み、廃棄物の気体(二酸化炭素)を排出します。肺はスポンジ状の伸縮性のある組織でできていて、あなたが呼吸をしている間に膨張したり収縮したりします。あなたが息を吸うと、横隔膜と肋間筋(肋骨の間の筋肉)が収縮して胸腔が広がり、肺の体積が大きくなります。体積の増加は、圧力の低下につながります(ボイルの法則)。これにより、肺に空気が流れ込みます(高圧から低圧へ)。あなたが息を吐くときには、プロセスが逆になります:横隔膜と肋骨の筋肉が弛緩し、胸腔が収縮し、肺の体積が減少し、圧力の増加を引き起こし(再びボイルの法則)、空気が肺から流出します(高圧から低圧へ)。そして、あなたは息を吸ったり吐いたりを繰り返し、生涯の間このボイルの法則のサイクルを繰り返します(図9.15)。
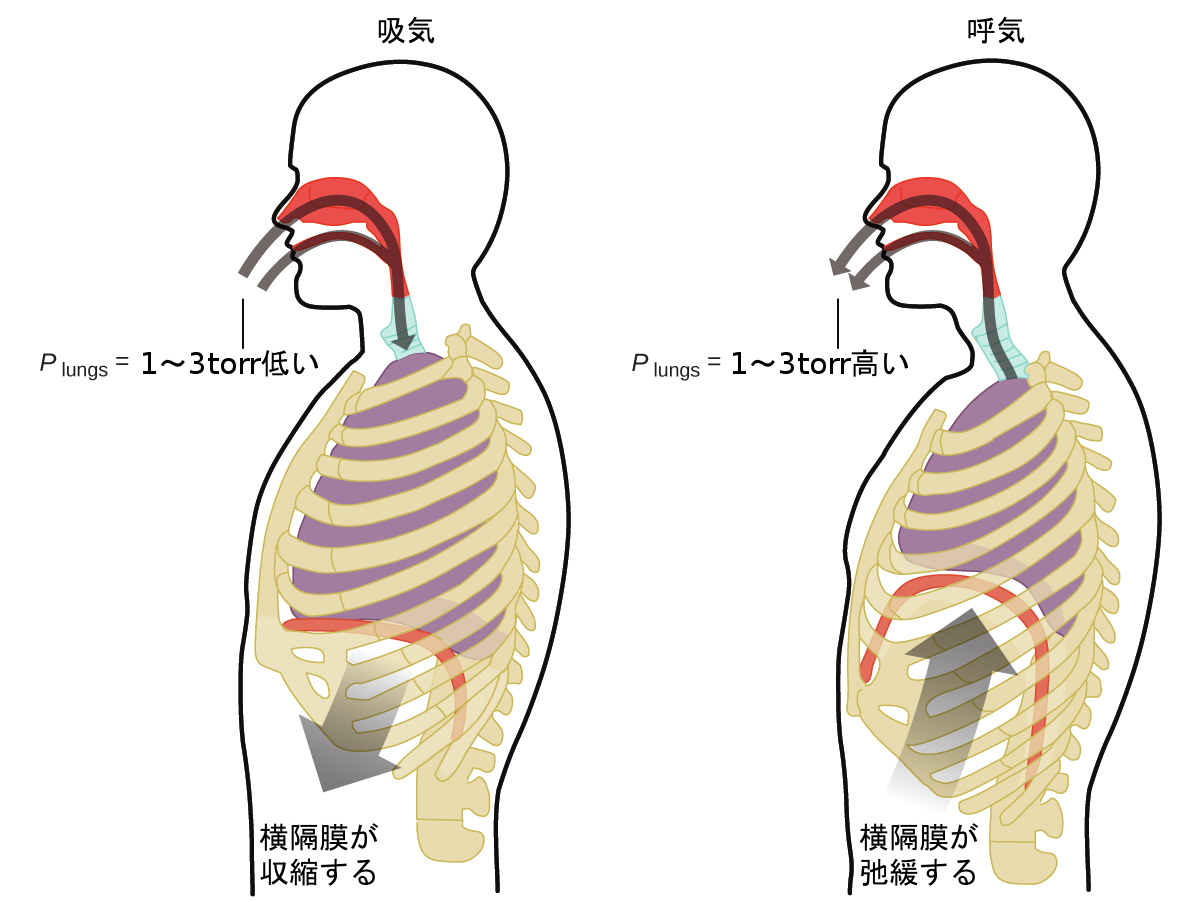
図9.15 | 呼吸は、肺の体積が膨張したり収縮したりすることで、あなたの肺と周囲環境との間に小さな圧力差を生じさせ、空気が肺に吸い込まれたり、肺から排出されたりするために起こります。
気体のモル数と体積:アボガドロの法則
イタリアの科学者アメデオ・アボガドロは、1811年に気体の振る舞いを説明するための仮説を立て、同じ温度と圧力の条件下で測定されたすべての気体の等しい体積の中には、同じ数の分子が含まれていると述べました。時間の経過とともに、この関係は多くの実験的観察によって裏付けられ、アボガドロの法則として表されるようになりました:閉じ込められた気体について、圧力と温度がともに一定であれば、体積(V)とモル数(n)は正比例します。これを式で表すと、以下のようになります:
\[ V ∝ n\\またはV = k × n\\または\frac{V_1}{n_1}=\frac{V_2}{n_2} \]
数学的な関係性は、Pとn、nとTのような他の変数のペアについても決定することができます。
学習へのリンク
このインタラクティブなPhETシミュレーション(http://openstaxcollege.org/l/16IdealGasLaw)にアクセスして、気体の圧力、体積、温度、量の関係を調べてみてください。シミュレーションを使用して、他のパラメータを一定に保った状態で、あるパラメータを変化させた場合の効果を調べてください(さまざまな気体の法則についての以前の項で説明したように)。
理想気体の法則
ここまで、気体の圧力、体積、温度、モル数に関係する4つの別々の法則が議論されてきました:
•ボイルの法則:PV = 一定(一定のTとnで)
•アモントンの法則:P/T = 一定(一定のVとnで)
•シャルルの法則:V/T = 一定(一定のPとnで)
•アボガドロの法則:V/n = 一定(一定のPとTで)
これらの4つの法則を組み合わせると、理想気体の法則、つまり気体の圧力、体積、温度、モル数の関係が得られます:
\[ PV = nRT \]
ここでPは気体の圧力、Vは気体の体積、nは気体のモル数、Tはケルビンスケールでの気体の温度、Rは理想気体定数または普遍気体定数と呼ばれる定数です。圧力、体積、温度を表すために使用される単位は、次元解析で必要とされる気体定数の適切な形を決定します、最も一般的な値は0.08206 L atm mol⁻¹ K⁻¹と8.314 kPa L mol⁻¹ K⁻¹です。
P、V、Tの性質が理想気体の法則(または他の気体の法則)によって正確に記述される気体は、理想的な振る舞いを示す、または、理想気体の性質に近似している、というように言われます。理想気体とは、この章の後の節で説明するように、気体の法則を効果的に説明するために、分子運動論と一緒に使用することができるような仮説的な構築物です。この節で提示されたすべての計算は理想的な振る舞いを仮定していますが、この仮定は比較的低い圧力と高い温度の条件下での気体に対してのみ妥当なものです。この章の最後の節では、比較的高い圧力と低い温度において多くの気体で観測される非理想的な振る舞いを説明するための、修正された気体の法則が導入されます。
理想気体の方程式は、気体定数Rと可変の性質P、V、n、Tの5つの項を含んでいます。これらの項のうちのいずれか4つを特定することで、理想気体の法則を使用して5番目の項を計算することができます。これは、以下の例題で示されています。
例題9.9 理想気体の法則を使用する
メタン(CH₄)は、ガソリンに代わる自動車用代替燃料としての利用が検討されています。1ガロンのガソリンを655gのCH₄によって置き換えることができます。25 °C、745 torrで、この量のメタンの体積はどれだけですか?
解法
私たちは、PV = nRTを並べ替えて、Vについて解かなければなりません:
\[ V =\frac{nRT}{P} \]
もしR = 0.08206 L atm mol⁻¹ K⁻¹を使用することを選択した場合、量はモルの単位でなければならず、温度はケルビンの単位でなければならず、圧力はatmの単位でなければなりません。
「正しい」単位に変換します:
\[ n = {\rm 6 55\ g\ CH_4 ×\frac{1\ mol}{16.043\ g\ CH_4}= 40.8 mol}\\ T = {\rm 25\ °C + 273 = 298\ K}\\ P = {\rm 745\ torr ×\frac{1\ atm}{760\ torr}= 0.980 atm}\\ V =\frac{nRT}{P}=\rm \frac{(40.8\ mol)(0.08206\ L\ atm\ mol^{–1}\ K^{–1})(298\ K)}{0.980\ atm}= 1.02 × 10^3\ L \]
1ガロンのガソリンを置き換えるためには、約1atmの圧力で1020L(269ガロン)の気体メタンが必要となるでしょう。数ガロンのガソリンを置き換えるためには、1atmで十分な量のメタンを保持するための大きな容器が必要です。
学習内容の確認
最新の水素駆動自動車の180Lの貯蔵タンクに27°Cで貯蔵された水素気体2520モルの圧力をバールで計算してください。
解答:350 bar
理想気体のモル数を2組の異なる条件下で一定にすると、組み合わされた気体の法則と呼ばれる便利な数学的関係が得られます:P₁V₁/T₁ = P₂V₂/T₂(atm、L、Kを使用)。どちらの条件の組もn × R(n = 気体のモル数、Rは理想気体の法則の定数)の積に等しいです。
例題9.10 組み合わされた気体の法則を利用する
空気を入れたとき、体積13.2Lの典型的なスキューバタンクの圧力は153atmです (図9.16)。もし水温が27°Cの場合、圧力が3.13atmの水深約70フィートの海では、このようなタンクから何リットルの空気がダイバーの肺に供給されるでしょうか?

図9.16 | スキューバダイバーは水中では圧縮された空気を使って呼吸をしています。(credit: modification of work by Mark Goodchild)
解法
添え字1をスキューバタンクの中の空気、添え字2を肺の中の空気を表すものとし、体温(肺の中の空気の温度)を37°Cとすると、以下のようになります:
\[ \frac{P_1V_1}{T_1}=\frac{P_2V_2}{T_2}⟶{\rm \frac{(153\ atm)(13.2\ L)}{(300\ K)}}=\frac{{\rm (3.13\ atm)}(V_2)}{\rm (310\ K)} \]
V₂について解くと:
\[ V_2 =\rm \frac{(153\ atm)(13.2\ L)(310\ K )}{(300\ K)(3.13\ atm)}= 667\ L \]
(注:この特定の例は、比較的高い圧力と低い温度の気体を含むために、理想気体の振る舞いという仮定はあまり妥当ではないということを忠告しておきます。この制限にもかかわらず、計算された体積は良い「目安」の推定値として見ることができます。)
学習内容の確認
27 °Cと0.850 atmの実験室条件下で、アンモニアの試料が0.250 Lの体積を占めていることがわかりました。この試料の0°Cと1.00 atmでの体積を求めてください。
解答:0.193 L
日常生活の中の化学
スキューバダイビングにおける水深と圧力の相互依存性
オーストラリアのグレートバリアリーフ(図9.17)であってもカリブ海であっても、スキューバダイビングをする際には、ダイバーは快適性と安全性に関連する多くの問題に対して圧力がどのように影響するかを理解していなければなりません。

図9.17 | グレートバリアリーフであってもカリブ海であっても、スキューバダイビングをするダイバーは、体内の圧力をかけられた気体に伴うリスクを避けるために、浮力、圧力の均等化、水中での滞在時間を意識しなければなりません。(credit: Kyle Taylor)
圧力は海の深さに応じて増加し、ダイバーが海面に到達する際に圧力は最も急速に変化します。ダイバーが経験する圧力は、ダイバーの上にあるすべての圧力(水からのものと空気からのもの)の総和です。ほとんどの圧力測定は、気圧の単位で行われており、ダイビング業界では「絶対気圧」または「ATA」と呼ばれています:海面での大気からの圧力は1ATAとなり、それに加えて海水の33フィートごとに1ATAの圧力がかかります。ダイバーが下降する際には、圧力が上昇することで耳や肺の中にある体のエアポケットが圧迫されます。上昇する際には、圧力が低下することでこれらのエアポケットが膨張し、鼓膜が破れたり肺が破裂したりする可能性があります。そのため、ダイバーは、下降時には通常の呼吸をして体の空間に空気を加え、鼻から息を吐いてマスクに空気を加えたり、均等化のテクニックを使って耳や副鼻腔に空気を加えたりして、均等化を行わなければなりません。上昇する際にも同じことが言えます。ダイバーは、均等化を維持するために体から空気を放出しなければなりません。浮力(ダイバーが沈むか浮くかを制御する能力)は、浮力調整具(BCD)によって制御されます。ダイバーが上昇中の場合、ボイルの法則(気体の圧力を下げると体積が増える)により、BCD内の空気は圧力が低下して膨張します。膨張した空気はダイバーの浮力を増加させ、ダイバーは上昇を開始します。ダイバーはBCDから空気を放出しなければなりません。さもなければ、制御できない上昇によって肺が破裂する危険性があります。下降時には、圧力の上昇によりBCD内の空気が圧縮され、ダイバーはより速く沈んでいきます。ダイバーはBCDに空気を入れなければならず、そうしなければ、制御不能な降下により海底近くのはるかに高い圧力に直面するリスクがあります。また、圧力は、ダイバーが上昇するまでに水中にどれだけの時間滞在できるかにも影響します。ダイバーが深海に潜れば潜るほど、圧力が上昇するために呼吸する空気は圧縮されます:もしダイバーが33フィートの深さに潜っている場合、圧力は2ATAで、空気は元の体積の2分の1に圧縮されるでしょう。ダイバーは水面の2倍の速さで使用可能な空気を使うことになります。
温度と圧力の標準条件
私たちは、所与の量の気体の体積と、所与の体積の気体中の分子の数(モル)は、圧力と温度の変化によって変化することを見てきました。化学者は、気体の性質を報告するために、標準的な温度および圧力(STP)と比較することがあります:STPは、273.15Kと1atm(101.325 kPa)です。[1]STPでは、理想気体の1モルの体積は約22.4Lであり、これを標準モル体積と呼びます(図9.18)。
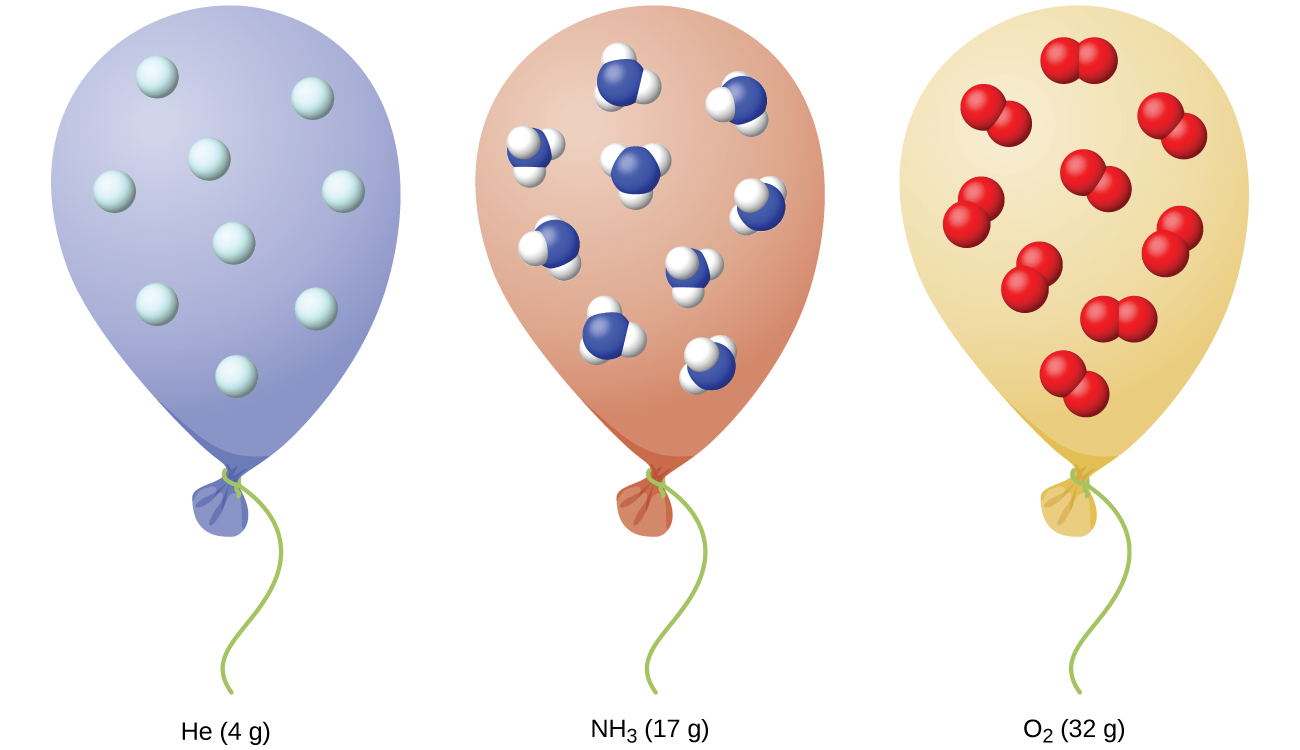
図9.18 | 化学的同一性に関係なく、理想的な振る舞いをする気体の1モルは、STPで~22.4 Lの体積を占めます。
9.3 気体の物質、混合物、反応の化学量論
この節が終わるまでに、あなたは次のことができるようになります:
•理想気体の法則を使用して気体の密度とモル質量を計算する
•気体状の物質が関連する化学量論的な計算を行う
•ドルトンの分圧の法則を述べ、それを用いて気体混合物が関連する計算を行う
気体の化学的な振る舞いの研究は、おそらく歴史上最も根本的な化学革命の基礎の一部をなしていました。フランスの貴族アントワーヌ・ラヴォアジエは、「近代化学の父」と広くみなされており、気体を使った研究を通じて化学を質的な科学から量的な科学へと変えました。彼は物質の保存の法則を発見したり、燃焼反応における酸素の役割を発見したり、空気の組成を決定したり、呼吸を化学反応の観点から説明したり、さらに多くのことを成し遂げました。彼はフランス革命の犠牲者であり、1794年にギロチンに処されました。彼の死について、数学者であり天文学者でもあるジョゼフ-ルイ・ラグランジュは、「暴徒が彼の頭を切り落とすのはほんの一瞬だが、彼の頭脳を取り戻すには1世紀でも十分ではないだろう」と述べました。[2]
この教科書の以前の章で説明したように、「どれだけですか?」と尋ねる質問の多くについての答えは、化学量論で求めることができます。そのようにして化学量論を利用する際に関連してくる本質的な性質とは、物質の量であり、それは一般的にはモル(n)で測定されます。気体の場合、モル量は圧力、温度、体積などの簡便な実験的測定値から導き出すことができます。したがって、これらの測定値は、純粋な気体、気体の混合物、気体が関与する化学反応の化学量論を評価するのに役立ちます。この節では、新しい物質や考え方を紹介することはありませんが、すでに議論した概念を統合するための方法や応用の例を提供します。
気体密度とモル質量
この章で以前に説明した理想気体の法則は、圧力P、体積V、温度T、モル量nという性質を関係付けています。この法則は普遍的なもので、気体の化学的同一性に関係なく、これらの性質を同じやり方で関連付けることができます:
\[ PV = nRT \]
一方、気体の密度dは、その同一性によって決定されます。この教科書の別の章で説明したように、物質の密度は、その物質を特定するために使用されることのある特徴的な性質です。
\[ d =\frac{m}{V} \]
理想気体の方程式を並べ替えて、Vを分離し、密度の式に代入すると、以下が得られます
\[ d =\frac{mP}{nRT}=\left(\frac{m}{n}\right)\frac{P}{RT} \]
比率m/nは、モル質量ℳの定義です:
\[ ℳ =\frac{m}{n} \]
密度の式は以下のように書くことができます
\[ d =\frac{ℳP}{RT} \]
この関係は、例題9.11で示されるように、圧力および温度の指定された値において既知の同一性の気体の密度を計算するために使用することができます。
例題9.11 気体の密度を測定する
STPでの窒素分子の気体の密度は何ですか?
解法
窒素分子N₂のモル質量は28.01 g/molです。この値を標準的な温度と圧力と一緒に気体の密度の式に代入すると、以下が得られます
\[ d =\frac{ℳP}{RT}=\rm \frac{(28.01\ g/mol)(1.00\ atm)}{(0.0821\ L·atm·mol^{−1} K^{−1} )(273\ K)}= 1.25\ g/L \]
学習内容の確認
17.0°C、760torrの圧力での水素分子の気体の密度は何ですか?
解答:d = 0.0847 g/L
気体の同一性が不明な場合、試料の質量、圧力、体積、温度の測定値を用いて、気体のモル質量(同定のプロセスに役立つ性質)を計算することができます。理想気体の方程式PV = nRTと、モル濃度の定義ℳ = m/nとを組み合わせると、以下の式が得られます:
\[ ℳ =\frac{mRT}{PV} \]
このアプローチによる気体のモル質量の決定が、例題9.12で示されています。
例題9.12 モル質量と経験式から気体の分子式を決定する
シクロプロパンは、かつて全身麻酔薬として酸素とともに使用されていた気体で、質量比で85.7%の炭素と、14.3%の水素で構成されています。その経験式を求めてください。もし1.56gのシクロプロパンが0.984atm、50°Cで1.00Lの体積を占めるとすると、シクロプロパンの分子式は何になりますか?
解法
まず、この気体の経験式を求めます。100gを仮定し、それぞれの元素の割合をグラムに換算します。100gのシクロプロパンの試料中の炭素と水素のモル数を決定します。炭素のモル数と水素のモル数を関係付けるために、モル数の最小の数で割ります。最後のステップで、最小の整数比が経験式であることがわかります:
\[ \rm 85.7\ g\ C×\frac{1\ mol\ C}{12.01\ g\ C}= 7.136\ mol\ C \hspace{20pt} \frac{7.136}{7.136}= 1.00\ mol\ C\\ 14.3\ g\ H×\frac{1\ mol\ H}{1.01\ g\ H}= 14.158\ mol\ H \hspace{20pt} \frac{14.158}{7.136}= 1.98\ mol\ H \]
経験式はCH₂[経験質量(EM)14.03g/経験単位]です。
次に、質量、圧力、温度、体積について与えられた値を使って、この気体のモル質量を計算します:
\[ ℳ =\frac{mRT}{PV}=\rm \frac{(1.56\ g)(0.0821\ L·atm·mol^{−1} K^{−1})(323\ K)}{(0.984\ atm)(1.00\ L)}= 42.0\ g/mol \]
モル質量と経験式質量を比較すると、分子を構成する経験式単位が何個あるかが示されます:
\[ \frac{ℳ}{EM}=\rm \frac{42.0\ g/mol}{14.0\ g/mol}= 3 \]
したがって、分子式は、経験式のそれぞれの添え字に3を掛けることによって導き出されます:
\[ \rm (CH_2)_3 = C_3 H_6 \]
学習内容の確認
溶接トーチの燃料であるアセチレンは、質量比で92.3%のCと、7.7%のHで構成されています。その経験式を求めてください。もし1.10gのアセチレンが1.15atm、59.5°Cで1.00Lの体積を占めるとすると、アセチレンの分子式は何になりますか?
解答:経験式、CH:分子式、C₂H₂
例題9.13 揮発性の液体のモル質量を決定する
揮発性の液体のおおよそのモル質量は、以下のようにして決定することができます:
上部に小さな穴の開いたフラスコの中に液体の試料を入れて加熱すると、液体は気体に変換されて、穴から抜け出ます。
液体の最後の一滴が気体になる瞬間にフラスコを熱からはずします。その時点でフラスコは、周囲の圧力のもと、気体状の試料のみで満たされていることになります。
フラスコを密閉し、気体状の試料を液体に凝縮させ、その後フラスコを計量して試料の質量を決定します(図9.19参照)。

図9.19 | フラスコ内の揮発性の液体が加熱されて沸点を超えると、それは気体となって空気をフラスコから追い出します。tₗ ⟶ gで、フラスコは大気と同じ圧力下で、揮発性の液体が気体になったもので満たされています。その後、フラスコを室温まで冷やすと、気体が凝縮し、フラスコに充満していた気体が液体になったときの質量を測定することができます。(credit: modification of work by Mark Ott)
この手順を用いて、0.494 gのクロロホルム気体の試料を、大気圧が742.1 mm Hgのときに、体積129 cm³、99.6 °Cのフラスコに集めました。クロロホルムのおおよそのモル質量は何ですか?
解法
ℳ = m/nおよびn = PV/RTであるため、代入して並べ替えるとℳ = mRT/PVとなります。したがって、
\[ ℳ =\frac{mRT}{PV}=\rm \frac{(0.494\ g) × 0.08206\ L·atm/mol\ K× 372.8\ K}{0.976\ atm× 0.129\ L}= 120\ g/mol \]
学習内容の確認
3.243×10⁻²gの重さのリンの試料は、56.0 mLの丸型フラスコの中では550 °Cで31.89 kPaの圧力を及ぼします。リン蒸気のモル質量と分子式は何ですか?
解答:124 g/mol、P₄
気体の混合物の圧力:ドルトンの法則
気体の混合物の中の個々の気体は、お互いに化学的に反応しない限り、お互いの圧力に影響を与えません。混合物中の個々の気体はそれぞれ、容器の中に単独で存在する場合と同じ圧力を及ぼします(図9.20)。混合物中の個々の気体のそれぞれが及ぼす圧力は分圧と呼ばれます。この観察はドルトンの分圧の法則によってまとめられています:理想気体の混合物の合計の圧力は、構成する気体の分圧の合計に等しいです:
\[ P_{Total} = P_A + P_B + P_C + ... = Σ_i P_i \]
この式の中で、PTotalは混合気体の合計の圧力であり、PAは気体Aの分圧、PBは気体Bの分圧、PCは気体Cの分圧、などです。
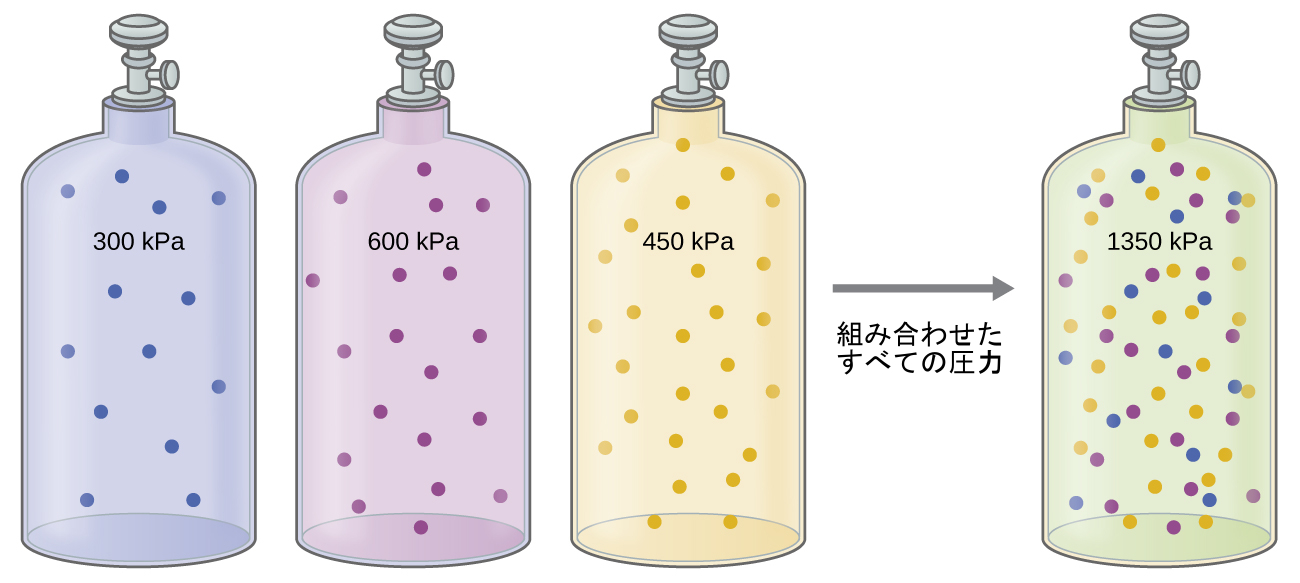
図9.20 | もし同じ容量のシリンダーにそれぞれ気体A(圧力300kPa)、気体B(圧力600kPa)、気体C(圧力450kPa)が入っており、それらすべてを同じ大きさの1つのシリンダーに入れた場合、混合物の合計の圧力は1350kPaとなります。
気体Aの分圧は、そのモル分率(X)を介して、気体混合物の全圧力に関係しています。モル分率(X)は、溶液中のある成分のモル数を全成分の合計モル数で割った値として定義される濃度の単位です:
\[ P_A = X_A × P_{Total} \hspace{10pt} ここで \hspace{10pt} X_A =\frac{n_A}{n_{Total}} \]
ここで、PA、XA、およびnAは、それぞれ気体Aの分圧、モル分率、およびモル数であり、nTotalは混合物中の全成分のモル数です。
例題9.14 気体の混合物の圧力
10.0Lの容器に、35°Cで2.50×10⁻³molのH₂、1.00×10⁻³molのHe、3.00×10⁻⁴molのNeが入っています。
(a)それぞれの気体の分圧は何ですか?
(b)全体の圧力は何気圧ですか?
解法
気体は独立して振る舞うので、それぞれの気体の分圧は、理想気体の方程式から、P = nRT/Vを使って決定することができます:
\[ P_{\rm H_2} ={\rm \frac{(2.50 × 10^{−3}\ mol)(0.08206\ L\ atm\ mol^{−1}\ K^{−1})(308\ K)}{10.0\ L}= 6.32 × 10^{−3}\ atm}\\ P_{\rm He} ={\rm \frac{(1.00 × 10^{−3}\ mol)(0.08206\ L\ atm\ mol^{−1}\ K^{−1})(308\ K)}{10.0\ L}= 2.53 × 10^{−3}\ atm}\\ P_{\rm Ne} ={\rm \frac{(3.00 × 10^{−4}\ mol)(0.08206\ L\ atm\ mol^{−1}\ K^{−1})(308\ K)}{10.0\ L}= 7.58 × 10^{−4}\ atm}\\ \]
全圧は分圧の和によって与えられます:
\[ P_{\rm T} = P_{\rm H_2} + P_{\rm He} + P_{\rm Ne} = \rm (0.00632 + 0.00253 + 0.00076)\ atm = 9.61 × 10^{−3}\ atm \]
学習内容の確認
5.73Lのフラスコには、25 °Cで0.0388 molのN₂、0.147 molのCO、0.0803 molのH₂が含まれています。フラスコ内の全体の圧力は何気圧ですか?
解答:1.137 atm
ここでは、この概念の別の例を示しますが、モル分率の計算を扱っています。
例題9.15 気体の混合物の圧力
麻酔薬として使用される気体の混合物には、2.83molの酸素O₂と 8.41molの亜酸化窒素N₂Oが含まれています。混合物の全体の圧力は192kPaです。
(a)O₂とN₂Oのモル分率は何ですか?
(b)O₂とN₂Oの分圧は何ですか?
解法
モル分率はXA=(nA)/(nTotal)で、分圧はPA=(XA)×(PTotal)で与えられます。
O₂について
\[ X_{\rm O_2} =\frac{n_{\rm O_2}}{n_{ Total}}={\rm \frac{2.83\ mol}{(2.83 + 8.41)\ mol}= 0.252}\\ P_{\rm O_2} = X_{\rm O_2} × P_{ Total} = {\rm 0.252 × 192\ kPa = 48.4\ kPa} \]
N₂Oについて
\[ X_{\rm N_2O} =\frac{n_{\rm N_2O}}{n_{ Total}}={\rm \frac{8.41\ mol}{(2.83 + 8.41)\ mol}= 0.748}\\ P_{\rm N_2O} = X_{\rm N_2O} × P_{ Total} = {\rm 0.748 × 192\ kPa = 143.6\ kPa} \]
学習内容の確認
体積が2.00Lの容器に20°Cで0.200gのH₂、1.00gのN₂、0.820gのArの混合物を入れたときの圧力は何ですか?
解答:1.87 atm
水上置換による気体の捕集
水と反応しない気体を捕集する簡単な方法は、水を入れた水槽の中で水を入れて逆さにした瓶に捕集することです。瓶を上げたり下げたりすることによって、瓶内の気体の圧力を外の空気圧と同じにすることができます。水位が瓶の内側と外側で同じであれば(図9.21)、気体の圧力は大気圧と等しくなります(大気圧は、気圧計で測定することができます)。
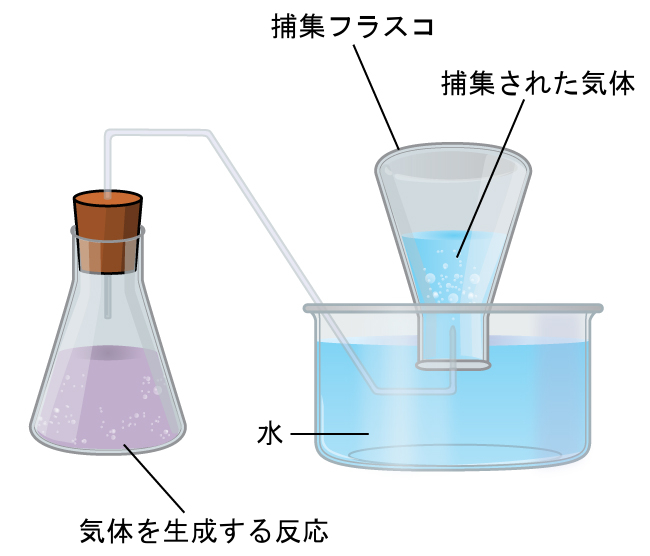
図9.21 | 反応で生成した気体が水上置換により捕集された場合、捕集された気体は、反応により発生した気体と水蒸気の混合物となります。もし捕集フラスコがフラスコの内側と外側の水位が等しくなるように適切に配置されていれば、捕集された気体の混合物の圧力はフラスコの外側の大気圧と等しくなるでしょう(以前のマノメーターについての議論を参照してください)。
しかしながら、この方法で気体の圧力を測定する際には、もう1つ考慮しなければならない要素があります。水は蒸発し、液体の水の試料の上には常に気体の水(水蒸気)があります。水上置換によって気体が捕集されると、それは水蒸気で飽和しており、混合物の全体の圧力は気体の分圧に水蒸気の分圧を加えたものになります。したがって、純粋な気体の圧力は、全体の圧力から水蒸気の圧力を引いた値に等しくなります—これを「乾いた」気体圧力、つまり水蒸気を含まない気体のみの圧力と呼びます。水の蒸気圧、つまり密閉容器の中で液体の水と平衡にある水蒸気が及ぼす圧力は温度に依存します(図9.22)。水蒸気の温度依存性に関するより詳細な情報は表9.2を参照してください。蒸気圧については、次の液体の章でより詳しく議論します。
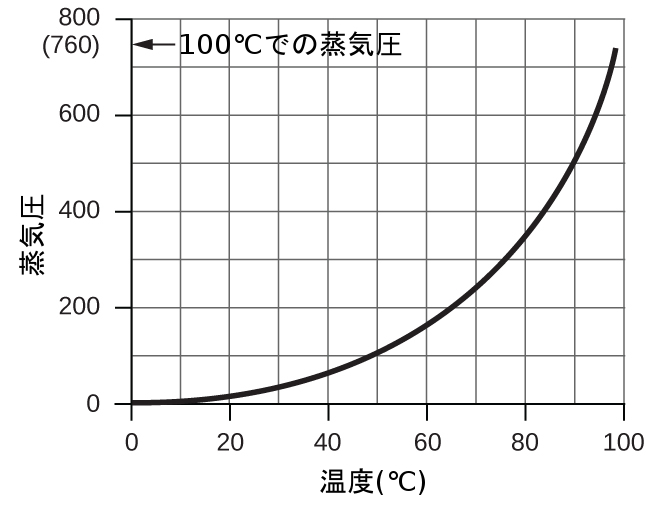
図9.22 | このグラフは海面における水の蒸気圧を温度の関数として示したものです。
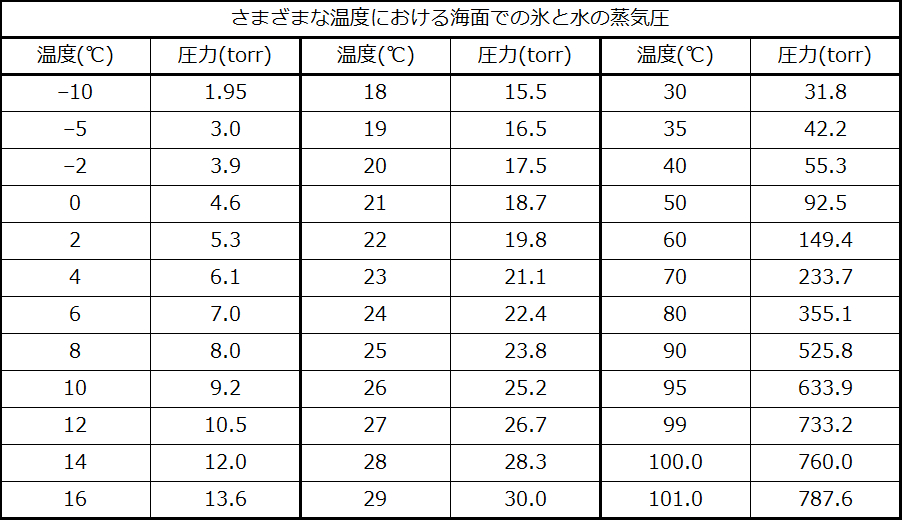
表9.2
例題9.16 水上置換で捕集した気体の圧力
図9.21に示されるような装置で、温度26°C、圧力750torrで水上置換により0.200Lのアルゴンを集めた場合、アルゴンの分圧は何ですか?
解法
ドルトンの法則によれば、瓶の内側の全体の圧力(750torr)は、アルゴンの分圧と気体状の水の分圧の和となります:
\[ P_{Total} = P_{\rm Ar} + P_{\rm H_2 O} \]
アルゴンの圧力について解くためにこの式を並べ替えると、以下のようになります:
\[ P_{\rm Ar} = P_{Total} - P_{\rm H_2 O} \]
26°Cでの液体の水の試料の水蒸気の圧力は25.2torr(付録E)なので:
\[ P_{\rm Ar} = \rm 750\ torr − 25.2\ torr = 725\ torr \]
学習内容の確認
温度29.0°C、圧力764torrで水上置換により捕集した酸素の試料の体積は0.560Lでした。同じ温度と圧力の条件下では、乾いた酸素の体積は何になるでしょうか?
解答:0.537 L
化学量論と気体
化学量論は、化学反応における反応物と生成物の間の定量的な関係性を記述します。
私たちはこれまで、固体の場合は質量を、溶液の場合はモル濃度と合わせて体積を使って、反応物と生成物の量を測定してきました。今では私たちは、気体の体積を使って量を表すこともできます。もし私たちが気体の体積、圧力、温度を知っているならば、理想気体の方程式を使って、その気体のモル数を計算することができます。もし私たちが気体のモル数を知っているならば、どのような温度と圧力でも気体の体積を計算することができます。
アボガドロの法則再考
私たちは、固体や溶液にはないような気体の化学量論の単純化された特徴を利用できることがあります:理想的な振る舞いを示すすべての気体は、(同じ温度と圧力で)同じ体積の中に同じ数の分子を含んでいます。したがって、化学反応に関与する気体の体積の比は、気体の体積が同じ温度と圧力で測定されていれば、その反応の反応式の係数によって与えられます。
私たちは、アボガドロの法則(ある気体の体積は気体のモル数に正比例する)を複数の気体の化学反応に拡張することができます:すべての気体の体積が同じ温度と圧力で測定されているならば、気体は体積による明確で単純な割合で組み合わさります(すなわち反応します)。たとえば、N₂(g) + 3H₂(g) ⟶ 2NH₃(g)に従って、窒素気体と水素気体が反応してアンモニア気体を生成します。このため、圧力と温度が一定であれば、所与の体積の窒素気体はその3倍の体積の水素気体と反応して2倍の体積のアンモニア気体を生成します。
これの説明が、図9.23に示されています。アボガドロの法則によれば、同じ温度と圧力で同じ体積の気体N₂、H₂、NH₃は同じ数の分子を含みます。N₂の1分子が3分子のH₂と反応して2分子のNH₃を生成するため、必要なH₂の体積はN₂の体積の3倍であり、生成されるNH₃の体積はN₂の体積の2倍です。
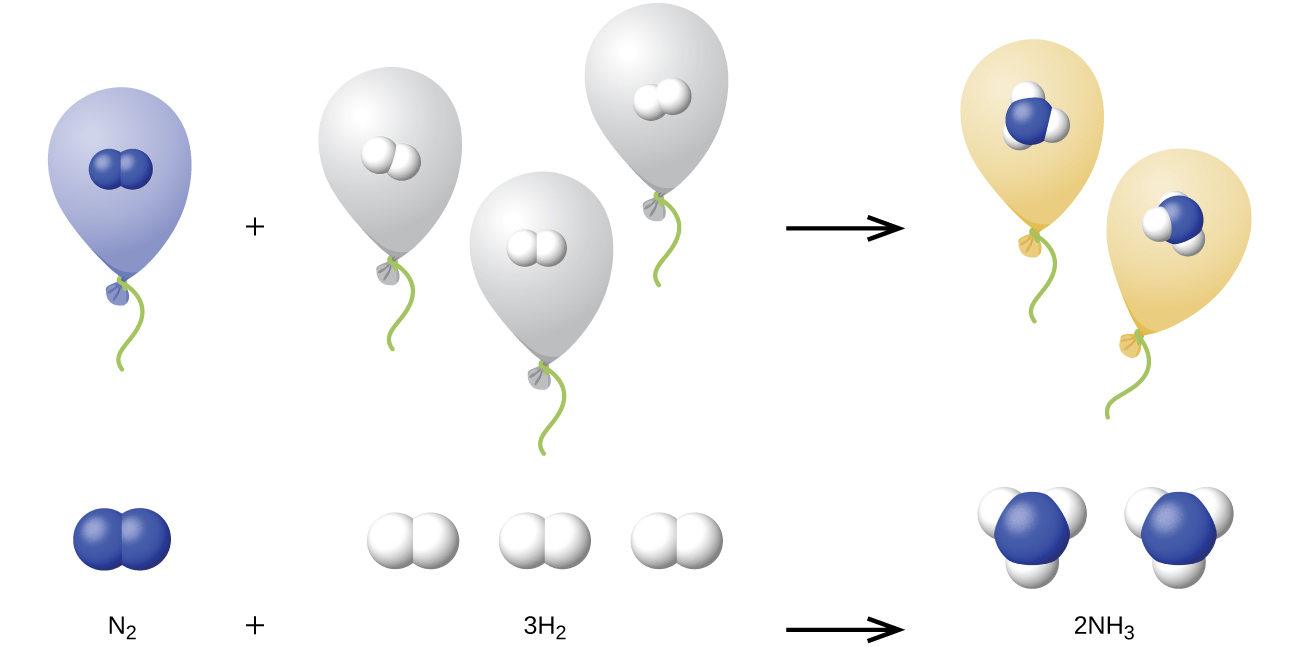
図9.23 | ある体積のN₂は3倍の体積のH₂と組み合わさって、2倍の体積のNH₃を生成します。
例題9.17 気体の反応
プロパンC₃H₈(g)は、調理用の熱を供給するためにガスグリルで使用されています。25 °C、760 torrで測定された2.7 Lのプロパンと反応するには、同じ温度・圧力条件下で測定されたO₂(g)はどれだけの体積が必要でしょうか?プロパンは完全燃焼すると仮定してください。
解法
C₃H₈とO₂の体積の比率は、バランスの取れた反応式におけるそれらの係数の比に等しくなるでしょう:
\[ \rm C_3 H_8\ (g) + 5O_2\ (g) ⟶ 3CO_2\ (g) + 4H_2 O\ (l)\\ 1体積 \hspace{5pt} + \hspace{3pt} 5体積 \hspace{50pt} 3体積 \hspace{9pt} + \hspace{4pt} 4体積\\ \]
反応式から、C₃H₈の1体積は5体積のO₂と反応することがわかります:
\[ \rm 2.7\ L\ C_3H_8 ×\frac{5\ L\ O_2}{1\ L\ C_3H_8}= 13.5\ L\ O_2 \]
2.7LのC₃H₈と反応するためには、13.5LのO₂の体積が必要になります。
学習内容の確認
酸素アセチレン溶接トーチ用のアセチレンタンクは、0°Cと1atmで9340Lのアセチレン気体C₂H₂を供給します。このアセチレンを燃焼させるには、0°Cと1atmで7.00 × 10³LのO₂を供給する酸素タンクが何個必要でしょうか?
\[ \rm 2C_2H_2 + 5O_2 ⟶ 4CO_2 + 2H_2O \]
解答:3.34個のタンク(2.34 × 10⁴L)
例題9.18 反応性気体の体積
アンモニアは重要な肥料であり、工業用化学物質です。6830億立方フィートの体積(25 °C、1atmで測定)の気体状のアンモニアが製造されたと仮定します。N₂と反応させてこの量のアンモニアを調製するためには、同じ条件下で測定されたH₂(g)の体積はどれだけ必要でしょうか?
\[ \rm N_2\ (g) + 3H_2\ (g) ⟶ 2NH_3\ (g) \]
解法
同じ体積のH₂とNH₃は同じ数の分子を含み、3つのH₂分子が反応するごとに2つのNH₃分子が生成されるので、H₂とNH₃の体積の比率は3:2に等しくなるでしょう。2体積(この場合の単位は立方フィート)のNH₃が、3体積のH₂から形成されることになります:
\[ \rm 6830億ft^3\ NH_3 ×\frac{30億ft^3\ H_2}{20億ft^3\ NH_3}= 1.02 × 10^{9}\ ft^3\ H_2 \]
6830億ft³のNH₃を製造するためには、1兆200億ft³のH₂が必要です。(25 °Cと1atmで。これは一辺の長さが約1.9マイルの立方体の体積です。)
学習内容の確認
25 °C、760 torrで測定された17.0 LのエチレンC₂H₄(g)と反応させるためには、同じ温度・圧力条件下で測定されたO₂(g)の体積はどれだけ必要でしょうか?生成物はCO₂と水蒸気です。
解答:51.0 L
例題9.19 気体の生成物の体積
8.88gのガリウムと過剰な塩酸を反応させると、27°Cと723torrでどれだけの体積の水素が生成されますか?
\[ \rm 2Ga\ (s) + 6HCl\ (aq) ⟶ 2GaCl_3\ (aq) + 3H_2\ (g) \]
解法
限定反応物であるGaの与えられた質量を、生成される水素のモルに変換します:
\[ \rm 8.88\ g\ Ga ×\frac{1\ mol\ Ga}{69.723\ g\ Ga}×\frac{3\ mol\ H_2}{2\ mol\ Ga}= 0.191\ mol\ H_2 \]
与えられた温度と圧力の値を適切な単位(それぞれKとatm)に変換し、水素気体のモル量と理想気体の方程式を使って気体の体積を計算します:
\[ V =\left(\frac{nRT}{P}\right)=\rm \frac{0.191\ mol × 0.08206\ L\ atm\ mol^{−1} K^{−1} × 300\ K}{0.951\ atm}= 4.94\ L \]
学習内容の確認
二酸化硫黄は硫酸を調製する際の中間体です。1.00kgの硫黄を過剰な酸素で燃焼させると、343°C、1.21atmでどれだけの体積のSO₂が生成されますか?
解答:1.30 × 10³L
さまざまな科学のつながり
温室効果ガスと気候変動
大気の薄い層によって地球は氷の惑星にならずにすみ、居住可能な状態となっています。実際のところ、これは空気の分子の0.5%未満によるものです。地球に届いた太陽からのエネルギーのうち、ほぼ1/3は宇宙空間に反射され、残りは大気と地球の表面によって吸収されます。地球が吸収したエネルギーの一部は赤外線(IR)放射として再放出され、その一部は大気を通って宇宙空間へと戻っていきます。しかしながら、この赤外線放射の大部分は、ある種の大気の気体によって吸収され、温室効果として知られる現象により、大気中に熱を効果的に閉じ込めています。この効果により、地球の温度は地球上での生命維持に必要な範囲内に保たれています。大気がなければ、地球の平均温度は30°C(ほぼ60°F)以上も下がることになるでしょう。主要な温室効果ガス(GHGs)は、水蒸気、二酸化炭素、メタン、オゾンです。産業革命以降、人間の活動により温室効果ガスの濃度が上昇しており、これによりエネルギーバランスが変化し、地球の気候を大きく変化させています(図9.24)。
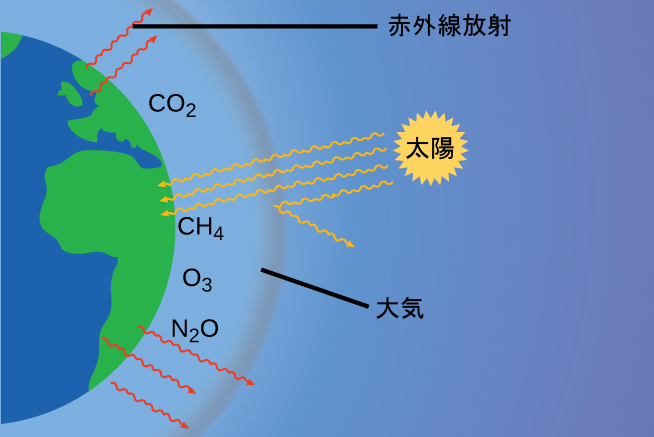
図9.24 | 温室効果ガスは、地球を居住可能な状態にするのに十分な太陽のエネルギーを閉じ込めています - これは温室効果として知られています。人間の活動は温室効果ガスの量を増やし、地球を温暖化させ、異常気象を引き起こしています。
大気中のCO₂レベルの上昇が人間の活動によって引き起こされていることを示す強い証拠が複数の情報源から得られており、化石燃料の燃焼が最近のCO₂増加の約3/4を占めています。氷床コアから得られた信頼できるデータによると、大気中のCO₂濃度は過去80万年で最も高いレベルにあることが明らかになっています。他の証拠は、2000万年で最も高いレベルになっている可能性があることを示しています。近年、CO₂濃度は産業革命以前の約280ppmから現在では400ppm以上に上昇しています(図9.25)。
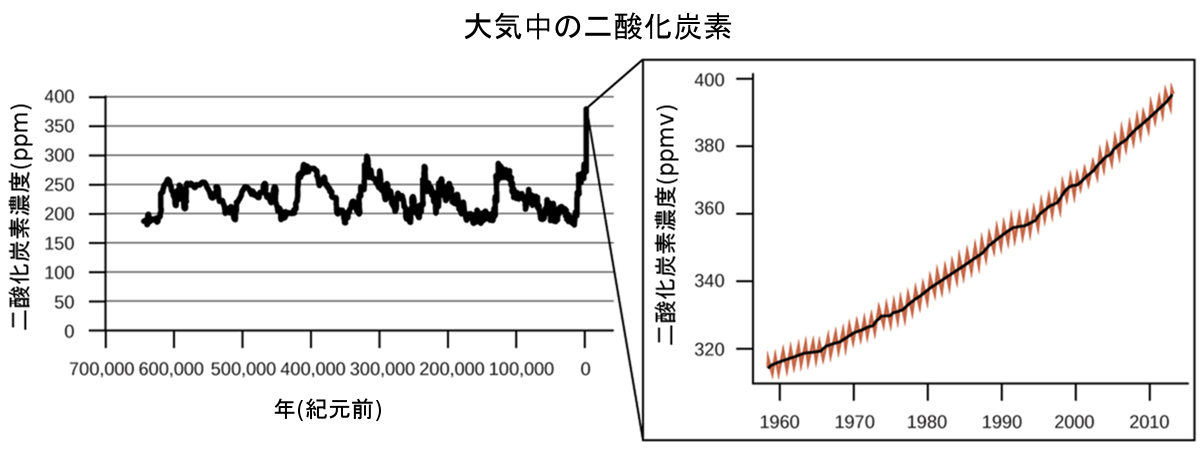
図9.25 | 過去70万年間のCO₂レベルは通常200~300ppmでしたが、過去50年間で前例のない急激な上昇を見せています。
学習へのリンク
温室効果ガスと地球温暖化について解説した2分間の動画を見るにはここ(http://openstaxcollege.org/l/16GlobalWarming)をクリックしてください。
化学者の肖像
スーザン・ソロモン
大気・気候科学者のスーザン・ソロモン(図9.26)は、ニューヨーク・タイムズ紙のブックス・オブ・ザ・イヤーのうちの1冊(「極寒の行進(The Coldest March)」(2001年))の著者であり、タイム誌の「世界で最も影響力のある100人」(2008年)の1人でもあり、また、2007年にノーベル平和賞を受賞した気候変動に関する政府間パネル(IPCC)のワーキンググループリーダーでもあります。彼女は、南極上空のオゾンホール形成の原因究明と説明に貢献し、気候変動に関する重要な論文を多数執筆しています。彼女は、米国とフランスで科学界の最高の栄誉(それぞれアメリカ国家科学賞、グランドメダイユ)を授けられており、米国科学アカデミー、王立協会、フランス科学アカデミー、欧州科学アカデミーの会員です。彼女は、元コロラド大学教授で、現在はマサチューセッツ工科大学(MIT)に在籍し、NOAAで研究を続けています。
詳しくは、スーザン・ソロモンについてのビデオ(http://openstaxcollege.org/l/16SusanSolomon)をご覧ください。

図9.26 | スーザン・ソロモンの研究は気候変動に焦点を当てており、南極上空のオゾンホールの原因究明に貢献しています。(credit: National Oceanic and Atmospheric Administration)
9.4 気体の浸出と拡散
この節が終わるまでに、あなたは次のことができるようになります:
•浸出と拡散を定義し、説明する
•グレアムの法則を記述し、それを使用して関連する気体の性質を計算する
もしあなたが今までに熱々のピザが配達された部屋にいたことがあるならば、あなたは気体の分子がすぐに部屋中に広がることができるという事実を認識したことでしょう(あなたの鼻にすぐに届く心地よい匂いで証明されているように)。気体分子は毎秒数百メートルという驚くべき速度で移動しますが、それらは目的の場所に到達するまでには、他の気体分子と衝突してさまざまな方向に移動しています。室温では、気体分子は毎秒数十億回の衝突を経験します。平均自由行程とは、分子が衝突と衝突の間に移動する平均距離のことです。平均自由行程は圧力が下がるにつれて増加します。一般的に、気体分子の平均自由行程は分子の直径の数百倍になります。
一般的に、気体の試料が閉じた容器の一部分に導入されると、その分子は非常に速く容器全体に分散することがわかっています。この濃度差に応じて分子が空間に分散するプロセスのことは、拡散と呼ばれます(図9.27に示されています)。もちろん、気体の原子や分子は濃度勾配を意識せず、単にランダムに移動しているだけです。高濃度の領域は低濃度の領域よりも粒子の数が多いため、高濃度の領域から低濃度の領域への種の正味の移動が起こります。閉じた環境では、図9.27に示されているように、拡散によって最終的には気体の濃度が全体で等しくなります。気体の原子と分子は移動を続けますが、両方の容器で濃度が同じなので、容器間の移動率は等しくなります(分子の正味の移動は起こりません)。
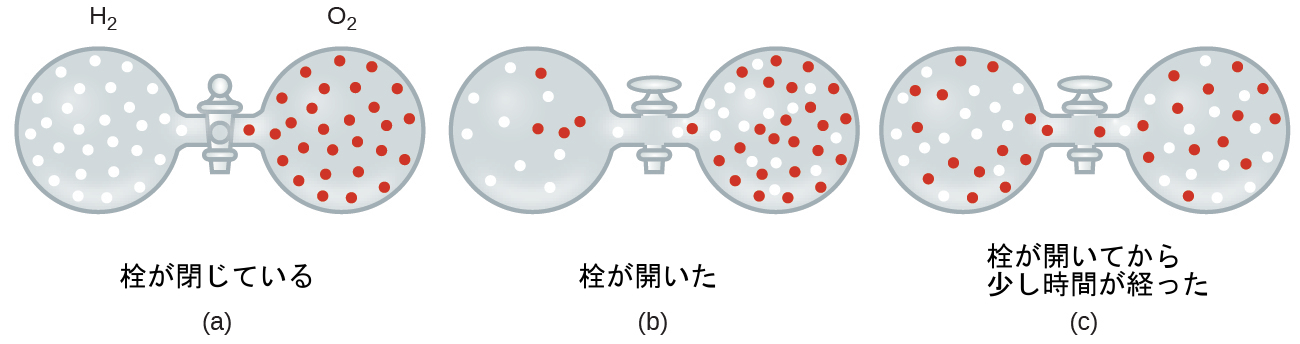
図9.27 | (a)最初に、2つの気体H₂とO₂が分離しています。(b)栓を開けると、両者は混合します。軽い気体であるH₂はO₂よりも早く開口部を通過するので、栓が開いた直後には、O₂がH₂側に移動するよりもH₂がO₂側に移動する方が多くなります。(c)しばらくすると、動きの遅いO₂分子と動きの速いH₂分子の両方が容器の両側に均等に分布しています。
私たちはしばしば、拡散率(単位時間あたりにある面積を通過する気体の量)に興味があります:
\[ 拡散率 =\frac{ある面積を通過する気体の量}{単位時間} \]
拡散率はいくつかの要因に依存します:濃度勾配(ある点から別の点への濃度の増減)、拡散に利用可能な表面積の量、および気体粒子が移動しなければならない距離です。また、拡散が起こるのに必要な時間は、拡散率に反比例することにも注意してください(拡散率の式で示されているように)。
拡散と似たような気体の種の移動を伴うプロセスとして、浸出があります。浸出とは、風船に開けられた針の穴のような小さな穴を通って気体分子が真空中に抜け出ることです(図9.28)。拡散率と浸出率はどちらも気体のモル質量に依存しますが、それらの率は同じものではありません。しかしながら、拡散率と浸出率の比率は同じになります。
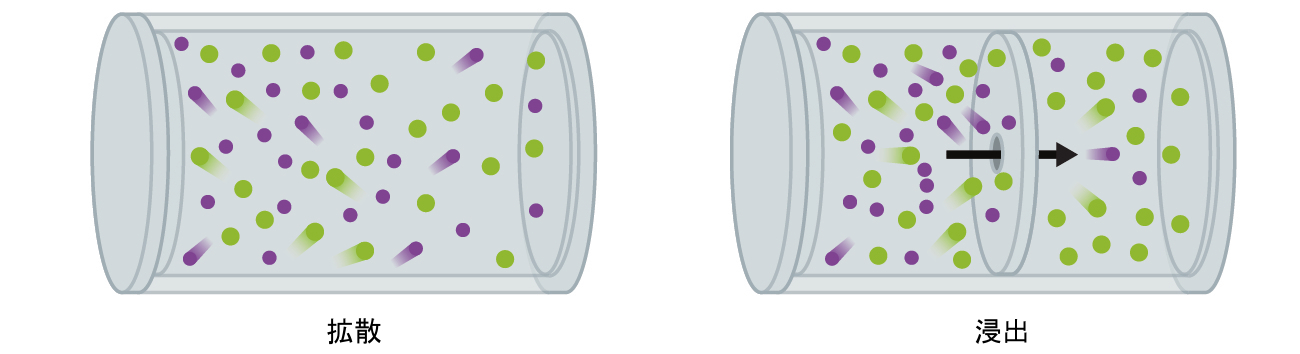
図9.28 | 拡散とは、分子がランダムな運動をすることで空間中に制約なしに分散していくことです。このプロセスが物理的な障壁に開けられた非常に小さな開口部を分子が通過するように制限されている場合、そのプロセスは浸出と呼ばれます。
もし穴を持つ壁のある容器の中に気体混合物を入れると、気体は壁の小さな開口部から浸出します。軽い気体は、重い気体よりも素早く(高い率で)小さな開口部を通過します(図9.29)。1832年、トーマス・グレアムはさまざまな気体の浸出率を研究し、浸出についてのグレアムの法則を定式化しました:気体の浸出率は、その粒子の質量の平方根に反比例します:
\[ 浸出率 ∝\ \frac{1}{\sqrt{ℳ}} \]
これは、もし2つの気体AとBが同じ温度と圧力であれば、それらの浸出率の比率は、その粒子の質量の平方根の比率に反比例することを意味します:
\[ \rm \frac{Aの浸出率}{Bの浸出率}=\frac{\sqrt{ℳ_B}}{\sqrt{ℳ_A}} \]

図9.29 | 左側の写真は、ヘリウム(オレンジ色)とアルゴン(青色)という異なる気体で膨らませた2つの風船を示しています。右側の写真は、充填してから約12時間後の風船を示しています。その時点では、ヘリウムの風船は、アルゴンの風船よりも顕著にしぼんでいます。これは、軽いヘリウム気体の浸出率が大きいためです。(credit: modification of work by Paul Flowers)
例題9.20 グレアムの法則を浸出率へと適用する
酸素の浸出率に対する水素の浸出率の比率を計算してください。
解法
グレアムの法則から、以下を得ます:
\[ \rm \frac{水素の浸出率}{酸素の浸出率}=\frac{\sqrt{32\ g\ mol^{−1}}}{\sqrt{2\ g\ mol^{−1}}}=\frac{\sqrt{16}}{\sqrt{1}}=\frac{4}{1}\\ \]
水素は酸素の4倍の速さで浸出します。
学習内容の確認
ある特定の圧力と温度では、窒素気体は79 mL/sの率で浸出します。同じ条件下では、二酸化硫黄はどれだけの率で浸出するでしょうか?
解答:52 mL/s
例題9.21 浸出時間の計算
4.46×10⁻⁵molのXeが小さな穴から浸出するのに243秒かかります。同じ条件下では、4.46×10⁻⁵molのNeが噴出するのにどれだけの時間がかかるでしょうか?
解法
時間を直接使いたいという誘惑に抵抗すること、そして、率が時間とどのように関係しているか、また質量とどのように関係しているかを覚えておくことが重要です。浸出率の定義を思い出してください:
\[ 浸出率 =\frac{移動した気体の量}{時間} \]
そして、それをグレアムの法則と組み合わせます:
\[ \rm \frac{Xe気体の浸出率}{Ne気体の浸出率}=\frac{\sqrt{ℳ_{Ne}}}{\sqrt{ℳ_{Xe}}} \]
以下が得られます:
\[ \rm \frac{\frac{移動したXeの量}{Xeについての時間}}{\frac{移動したNeの量}{Neについての時間}}=\frac{\sqrt{ℳ_{Ne}}}{\sqrt{ℳ_{Xe}}} \]
Aの量=Bの量であることに注目し、Neについての時間で解きます:
\[ \rm \frac{\frac{Xeの量}{Xeについての時間}}{\frac{Neの量}{Neについての時間}}=\frac{Neについての時間}{Xeについての時間}=\frac{\sqrt{ℳ_{Ne}}}{\sqrt{ℳ_{Xe}}} \]
値を代入します:
\[ \rm \frac{Neについての時間}{243\ s}=\sqrt{\frac{20.2\ g\ mol}{131.3\ g\ mol}}= 0.392 \]
最後に、目的の量について解きます:
\[ \rm Neについての時間 = 0.392 × 243\ s = 95.3\ s \]
この答えは妥当であることに注意してください:NeはXeよりも軽いので、Neの浸出率はXeの浸出率よりも大きくなるでしょう。これは、Neの浸出時間はXeの浸出時間よりも小さくなることを意味します。
学習内容の確認
ヘリウムで満たされたパーティー用の風船は、8.0時間で元の体積の2/3にしぼみます。同一の風船を同じモル数の空気(ℳ = 28.2 g/mol)で満たしたとき、それが元の体積の1/2にしぼむまでには、どれだけの時間がかかるでしょうか?
解答:32時間
例題9.22 グレアムの法則を用いてモル質量を決定する
ある未知の気体は、CO₂の1.66倍の速さで浸出します。この未知の気体のモル質量は何ですか?あなたはその正体について合理的な推測ができますか?
解法
グレアムの法則から、以下を得ます:
\[ \rm \frac{未知の気体の浸出率}{CO_2の浸出率}=\frac{\sqrt{ℳ_{CO_2}}}{\sqrt{ℳ_{未知}}} \]
既知のデータを挿入します:
\[ \rm \frac{1.66}{1}=\frac{\sqrt{44.0\ g/mol}}{\sqrt{ℳ_{未知}}} \]
解きます:
\[ \rm ℳ_{未知} =\frac{44.0\ g/mol}{(1.66)^2}= 16.0\ g/mol \]
この気体はおそらく、このモル質量を持つ唯一の気体であるCH₄でしょう。
学習内容の確認
水素の気体は未知の気体の8.97倍の速さで穴のある容器から浸出します。この未知の気体のモル質量を推定してください。
解答:163 g/mol
さまざまな科学のつながり
拡散を原子力の用途へ利用する:ウラン濃縮
気体の拡散は、原子力発電所や核兵器に使用される濃縮ウランの製造に利用されています。自然界に存在するウランには、核分裂の連鎖反応を持続できる「核分裂性」のウランである²³⁵Uが0.72%しか含まれていません。原子炉の燃料には2~5%の²³⁵Uが必要で、核爆弾にはそれ以上の濃度が必要です。ウランを所望のレベルまで濃縮する方法の1つに、グレアムの法則を利用するものがあります。気体拡散型の濃縮プラントでは、六フッ化ウラン(UF₆、ウラン化合物の中で十分な揮発性のある唯一のもの)を、拡散器と呼ばれる大きな円筒形の容器にゆっくりと送り込みます。拡散器の中には、微細な開口部である穴が多くあいた障壁が収容されています。障壁の反対側は空気が抜かれているわけではないため、このプロセスは拡散の一種です。平均速度が速い²³⁵UF₆分子は、重い²³⁸UF₆分子よりも少し速く障壁を通過して拡散します。障壁を通過した気体は²³⁵UF₆がわずかに濃縮されており、残留した気体はわずかに希釈されています。²³⁵UF₆と²³⁸UF₆の分子の重さの差はわずかであるため、1台の拡散器では0.4%程度しか濃縮されません(図9.30)。しかし、多くの拡散器を段階的に接続することで(カスケードと呼ばれます)、所望の濃縮レベルを達成することができます。
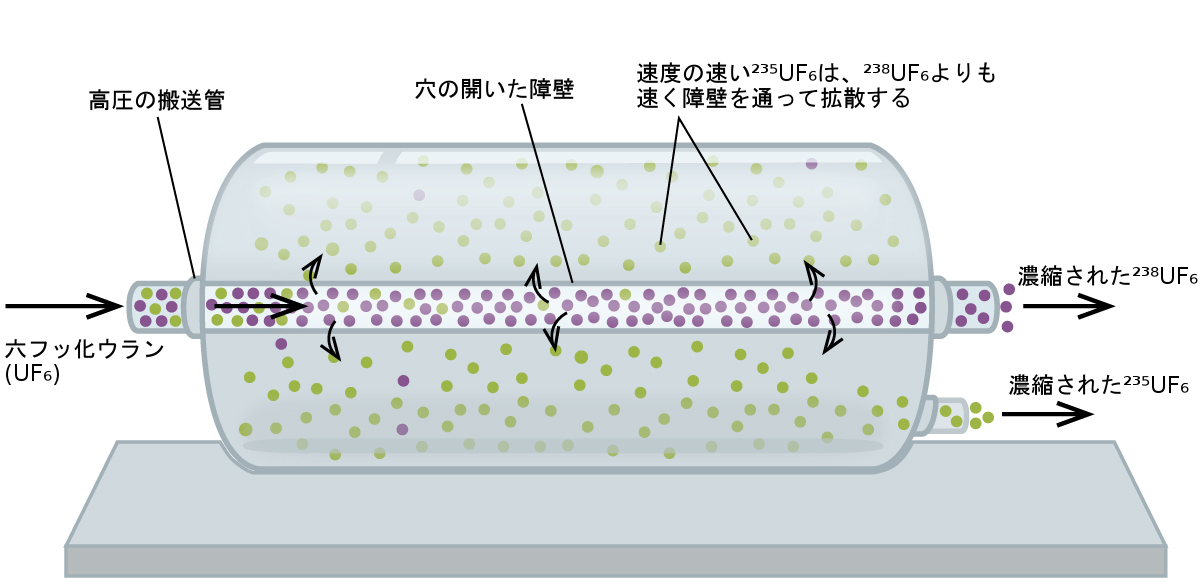
図9.30 | 拡散器では、気体状のUF₆が穴の開いた障壁を通るように送り込まれ、²³⁵UF₆と²³⁸UF₆が部分的に分離されます。²³⁵UF₆が十分に濃縮されるまでには、UF₆は多数の拡散器ユニットを通過しなければなりません。
第二次世界大戦中、マンハッタン計画(最初の原子爆弾の開発)の一環として、テネシー州オークリッジの原子力施設で初めて気体の²³⁵UF₆と²³⁸UF₆の大規模な分離が行われました。理論は単純ですが、実際に機能させるためには、多くの困難な技術的課題を克服しなければなりませんでした。障壁には、直径約10⁻⁶cmの小さな均一な穴がなければならず、高い流量とするためには十分に多くの穴がなければなりません。すべての材料(障壁、管、表面コーティング、潤滑剤、ガスケット)は、反応性も腐食性も高いUF₆と反応せずに、封じ込めることができる必要があります。
気体拡散型のプラントでは、非常に大量のエネルギーを必要とするため(気体を必要な高圧まで圧縮して拡散器カスケードを通過させ、圧縮時に発生する熱を除去するなど)、現在では、はるかに少ないエネルギーで済む気体遠心分離技術に取って代わられています。現在話題となっている政治的な問題は、イランが核兵器を作るのに使うことのできる十分な濃縮ウランを生産しないようにするために、この技術をいかにしてイランに与えないようにするかということです。
9.5 分子運動論
この節が終わるまでに、あなたは次のことができるようになります:
•分子運動論の仮定を述べる
•気体の法則を説明するために、この理論の仮定を使用する
私たちがこれまでに見てきた気体の法則や理想気体の方程式は経験的なもの、つまり実験的な観測から導き出されたものです。これらの法則の数学的な形式は、圧力が約1atmや2atm未満のほとんどの気体の巨視的な振る舞いを的確に記述しています。気体の法則は、多くの実験で検証されている関係を記述していますが、気体がなぜこの関係に従うのかを教えてくれるものではありません。
分子運動論(KMT)は、本章の以前の節で記述した気体の法則を効果的に説明する単純な微視的モデルです。この理論は、ここに記した以下の5つの仮定に基づいています。(注:気体の中には貴ガスのように原子種で構成されているものもありますが、ここでは気体を構成する個々の化学種を指すために「分子」という用語を使います。)
気体は、連続した運動をしている分子からなり、直線上を移動して、他の分子と衝突したり容器の壁に衝突したりしたときにのみ方向を変えます。
気体を構成する分子の大きさは、分子間の距離に比べて無視できるほど小さいです。
容器の中の気体が及ぼす圧力は、気体分子と容器の壁との衝突によって生じます。
気体分子はお互いや容器の壁には引力も反発力も及ぼしません。したがって、衝突は弾性的です(エネルギーの損失を伴いません)。
気体分子の平均運動エネルギーは、気体のケルビン温度に比例します。
KMTとその仮定を評価する基準は、それが気体の振る舞いを説明し、記述する能力にあります。さまざまな気体の法則は、KMTの仮定から導き出すことができ、そのため化学者たちはこの理論の仮定が気体分子の性質を正確に表していると考えています。私たちはまず、個々の気体の法則(ボイルの法則、シャルルの法則、アモントンの法則、アボガドロの法則、ドルトンの法則)を概念的に眺めて、KMTがそれらをどのように説明しているのかを見ていきます。その後、私たちは分子の質量、速度、および運動エネルギーと温度との関係性をより丁寧に考察し、グレアムの法則を説明します。
分子運動論が説明する気体の振る舞い、その1
気体の圧力は、素早く移動する気体分子によって及ぼされ、単位時間あたりに壁の単位面積に衝突する分子の数に直接依存していることを思い出すと、KMTは、気体の振る舞いを以下のように概念的に説明していることがわかります:
•アモントンの法則。もし温度が増加すると、気体分子の平均速度と運動エネルギーが増加します。体積が一定に保たれるならば、気体分子の増加した速度によって、容器の壁への衝突は回数が多くなり、より大きな力となります。したがって、圧力が高くなります(図9.31)。
•シャルルの法則。もし気体の温度が増加すると、気体が占める体積が増える場合でのみ一定の圧力が維持されます。これにより、分子が容器の壁に到達するまでの平均移動距離が長くなり、壁の表面積が増加します。これらの条件は、分子と壁の衝突の頻度と単位面積あたりの衝突回数の両方を減少させ、これらの複合効果が、より高い温度でのより大きな運動エネルギーによる衝突力の増加の影響を相殺します。
•ボイルの法則。もし気体の体積が減少すると、容器の壁面積が減少するとともに、分子と壁の衝突頻度が増加し、この両方によって気体が及ぼす圧力が増加します(図9.31)。
•アボガドロの法則。一定の圧力と温度では、分子と壁の衝突の頻度と力は一定です。このような条件下では、気体分子の数を増やすには、単位面積あたりの衝突回数を減少させて衝突頻度の増加を相殺するために、容器の体積を比例的に増加させる必要があります(図9.31)。
•ドルトンの法則。混合気体の分子間の距離が大きいため、混合気体のうちのある1つの気体の分子は、他の気体が存在するか否かにかかわらず、同じ頻度で容器の壁に衝突します。気体の混合物の全体の圧力は、個々の気体の圧力(分圧)の合計に等しいです。
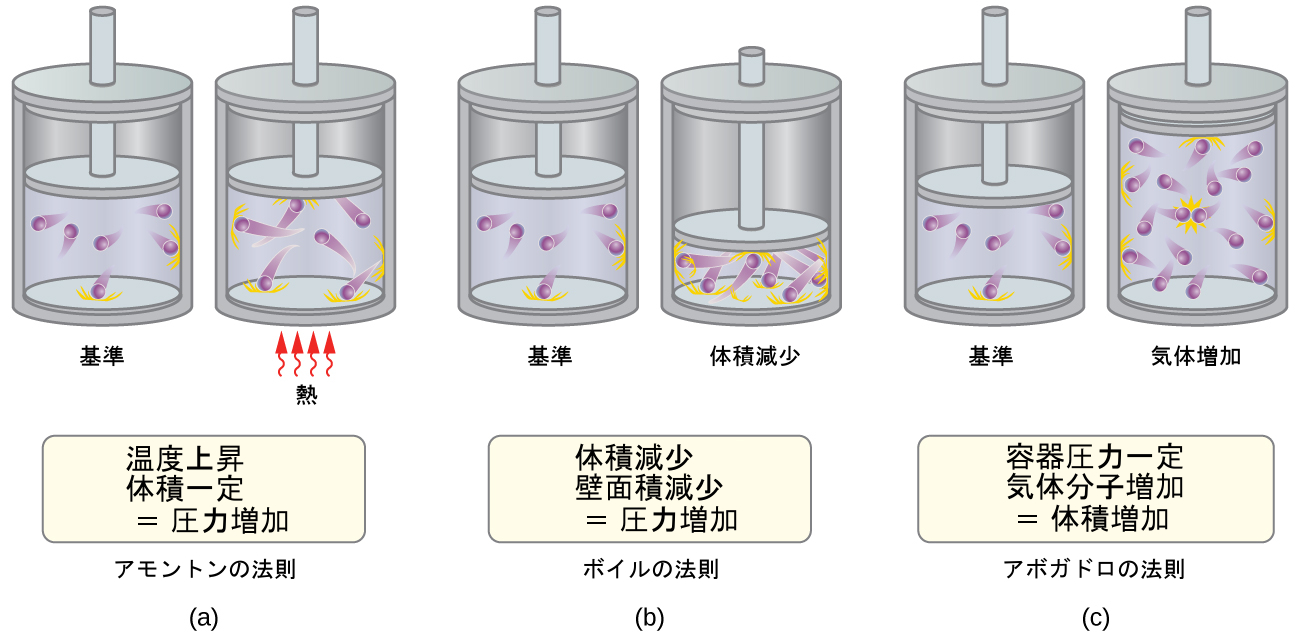
図9.31 | (a)気体温度が上昇すると、分子の衝突の力と頻度が増加するため気体の圧力が増加します。(b)体積が減少すると、分子の衝突の頻度が増加するため気体の圧力が増加します。(c)一定の圧力で気体の量が増加すると、体積が増加して単位時間あたりの単位壁面積あたりの衝突回数が一定になります。
分子の速度と運動エネルギー
これまでの議論では、KMTがさまざまな気体の法則で記述された振る舞いを定性的に説明できることが示されました。この理論の仮定をより定量的な形で適用することによって、個々の法則を導き出すことができるかもしれません。それを行うためには、私たちはまず、気体分子の速度と運動エネルギー、そして気体試料の温度を見なければなりません。
気体試料中では、個々の分子の速度は大きく異なります。しかしながら、分子の数や衝突の数が膨大であるため、分子の速度分布や平均速度は一定です。この分子の速度分布はマクスウェル-ボルツマン分布として知られており、それは気体のバルク試料の中で、ある速度を持つ分子の相対的な数を表しています(図9.32)。
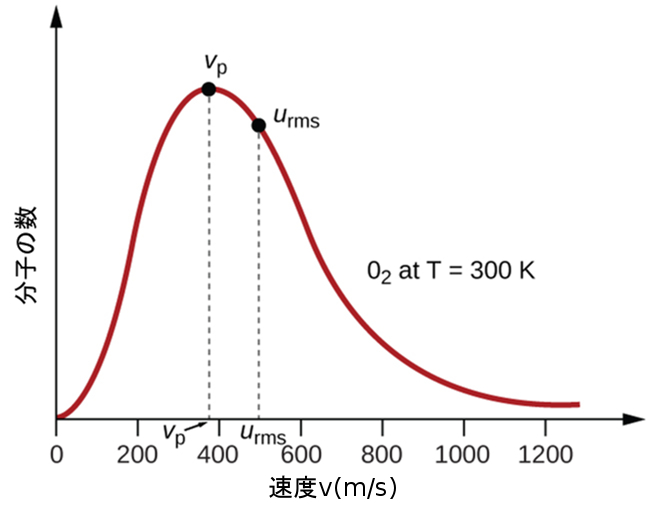
図9.32 | 酸素気体の300Kでの分子の速度分布がここに示されています。非常に遅い速度または非常に速い速度で動く分子は非常に少ないです。中間の速度を持つ分子の数は最大数まで急速に増加し、それが最も可能性の高い速度となり、その後急速に減少していきます。最も可能性の高い速度νpは400m/sを少し下回る程度であり、二乗平均平方根速度urmsは500m/sに近いことに注意してください。
質量(m)と速度(u)の粒子の運動エネルギー(KE)は以下の式で与えられます:
\[ {\rm KE} =\frac{1}{2}mu^2 \]
質量をキログラム、速度をメートル/秒で表現すると、エネルギー値はジュール(J = kg m²s⁻²)の単位で得られます。多数の気体分子を扱うために、私たちは速度と運動エネルギーの両方について平均値を使用します。KMTでは、粒子の二乗平均平方根速度urmsは、n = 粒子数の場合の速度の二乗平均の平方根として定義されます:
\[ u_{\rm rms} = \sqrt{\overline{u^2}} =\sqrt{\frac{u_1^2+ u_2^2+ u_3^2+ u_4^2+ …}{n}}\\ \]
粒子の1モルの平均運動エネルギーKEavgは、以下のようになります:
\[ {\rm KE_{avg}} =\frac{1}{2} Mu_{\rm rms}^2 \]
ここで、Mはkg/molの単位で表されるモル質量です。気体分子の1モルのKEavgはまた、気体の温度に正比例しており、以下の式で表されます:
\[ {\rm KE_{avg}} =\frac{3}{2}RT \]
ここでRは気体定数、Tはケルビン温度です。この式に用いる場合、気体定数の適切な形は8.314 J/mol⋅K (8.314 kg m²s⁻²mol⁻¹K⁻¹)となります。KEavgについてのこの2つの別々の式を組み合わせて、並べ替えると、分子速度と温度の関係が得られます:
\[ \frac{1}{2}Mu_{\rm rms}^2=\frac{3}{2}RT\\ u_{\rm rms} =\sqrt{\frac{3RT}{M}} \]
例題9.23 urmsの計算
30°Cにおける窒素分子の二乗平均平方根速度を計算してください。
解法
温度をケルビンに変換します:
\[ {\rm 30 °C + 273 = 303\ K} \]
窒素のモル質量をキログラム単位で決定します:
\[ {\rm \frac{28.0\ g}{1\ mol}×\frac{1\ kg}{1000\ g}= 0.028\ kg/mol} \]
二乗平均平方根速度の方程式の変数と定数を置き換え、ジュールを等価なkg m²s⁻²に置き換えます:
\[ u_{\rm rms} =\sqrt{\frac{3RT}{M}}\\ u_{\rm rms} =\rm \sqrt{\frac{3(8.314\ J/mol\ K)(303\ K)}{(0.028\ kg/mol)}}= \sqrt{2.70 × 10^5\ m^2 s^{−2}} = 519\ m/s \]
学習内容の確認
酸素分子1モルの-23°Cにおける二乗平均平方根速度を計算してください。
解答:441 m/s
気体の温度が上昇すると、KEavgが上昇し、より多くの分子が高速になり、より少ない分子が低速になり、分布は全体的に高速になる方向、つまり右側にシフトします。もし温度が下がると、KEavgが低下し、より多くの分子が低速になり、より少ない分子が高速になり、分布は全体的に低速になる方向、つまり左側にシフトします。窒素気体の場合のこの振る舞いが図9.33に示されています。
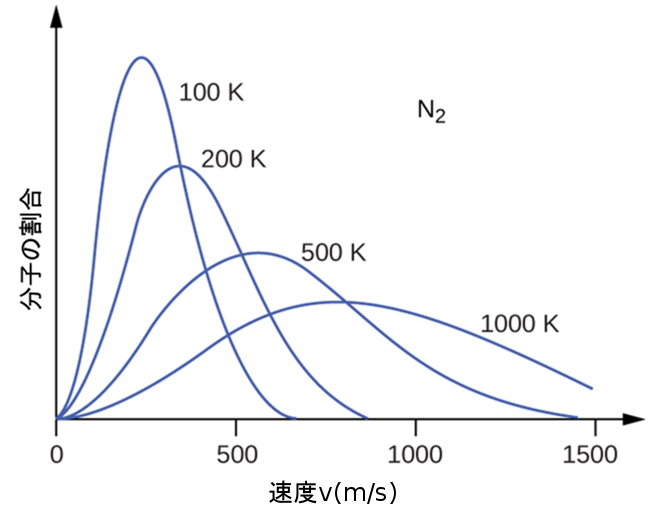
図9.33 | 窒素気体(N₂)の分子の速度分布は、温度が上がるにつれて右側にシフトして平坦になり、温度が下がるにつれて左側にシフトして急峻になります。
所与の温度では、すべての気体の分子のKEavgは同じです。軽い分子で構成されている気体は、より多くの高速の粒子と高いurmsを持っており、相対的に高い速度にピークのある速度分布となります。重い分子からなる気体は、より多くの低速の粒子と低いurmsを持っており、相対的に低い速度にピークのある速度分布となります。この傾向は、図9.34に示される一連の貴ガスのデータによって示されています。
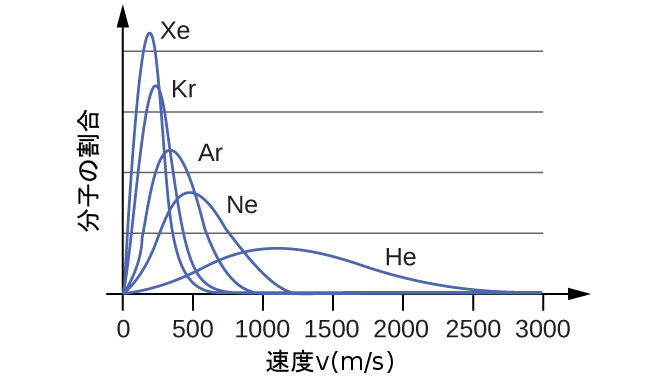
図9.34 | 分子速度は分子量と直接関係しています。所与の温度では、軽い分子の方が重い分子よりも平均的に速く動きます。
学習へのリンク
分子速度に対する温度の影響を調べるには、気体シミュレータ(http://openstaxcollege.org/l/16MolecVelocity)を使うことができます。シミュレータの「エネルギーヒストグラム(energy histograms)」(分子の速度分布)と「種の情報(species information)」(平均速度値を与えます)を、さまざまな温度での色々な質量の分子について調べてみてください。
分子運動論が説明する気体の振る舞い、その2
グレアムの法則によれば、気体の分子は素早く運動しており、分子自体は小さいです。気体の分子間の平均距離は分子の大きさに比べて大きいです。その結果、気体の分子同士は簡単にすれ違い、比較的速い速度で拡散することができます。
気体の浸出率は、その分子の(平均)速度に直接依存します:
\[ 浸出率 ∝ u_{\rm rms} \]
この関係、および分子速度と質量との関係式を用いて、グレアムの法則は以下のように簡単に導き出すことができます:
\[ u_{\rm rms} =\sqrt{\frac{3RT}{M}}\\ M =\frac{3RT}{u_{\rm rms}^2}=\frac{3RT}{\overline{u^2}}\\ \frac{\rm Aの浸出率}{\rm Bの浸出率}=\frac{u_{\rm rms\ A}}{u_{\rm rms\ B}}= \frac{\sqrt{\frac{3RT}{M_{\rm A}}}}{\sqrt{\frac{3RT}{M_{\rm B}}}}= \sqrt{\frac{M_{\rm B}}{M_{\rm A}}} \]
このようにして、浸出率の比率は、それらの質量の平方根の比に反比例するものとして導き出されます。これは実験的に観測され、グレアムの法則として表現されたものと同じ関係です。
9.6 非理想気体の振る舞い
この節が終わるまでに、あなたは次のことができるようになります:
•理想気体の振る舞いからの逸脱につながる物理的因子を記述する
•これらの因子がファン・デル・ワールス方程式でどのように表現されるかを説明する
•圧縮率(Z)を定義し、圧力による圧縮率の変化がどのように非理想的な振る舞いを反映するかを記述する
•理想気体の法則とファン・デル・ワールス方程式を用いた気体の性質の計算を比較することによって、非理想的な振る舞いを定量化する
これまで、理想気体の法則であるPV = nRTは、反応の化学量論や経験式・分子式の問題から、気体の密度やモル質量の決定に至るまで、さまざまな異なる種類の問題に適用されてきました。しかしながら、この章の以前の節で述べたように、気体の振る舞いはしばしば非理想的なものです。これは、圧力、体積、温度の間の観察された関係が、気体の法則によって正確に記述されないことを意味します。この節では、理想的な気体の振る舞いからの逸脱の理由について考察します。
PV = nRTの正確さを判断する方法の1つとして、同じ温度・圧力で、1モルの気体の実際の体積(そのモル体積Vₘ)と理想気体のモル体積とを比較する方法があります。この比率のことを圧縮率因子(Z)といいます:
\[ {\rm Z} =\frac{同じTとPでの気体のモル体積}{同じTとPでの理想気体のモル体積}=\left(\frac{PV_m}{RT}\right)_{測定} \]
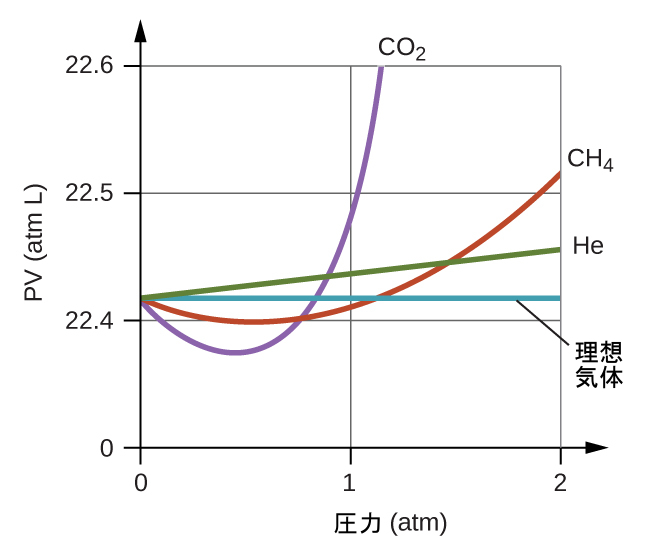
したがって、この比率が1に等しいときには理想気体の振る舞いが示され、この比率が1から逸脱したときは非理想的な振る舞いを示します。図9.35は、いくつかの一般的な気体について、広い圧力の範囲におけるZのプロットを示しています。
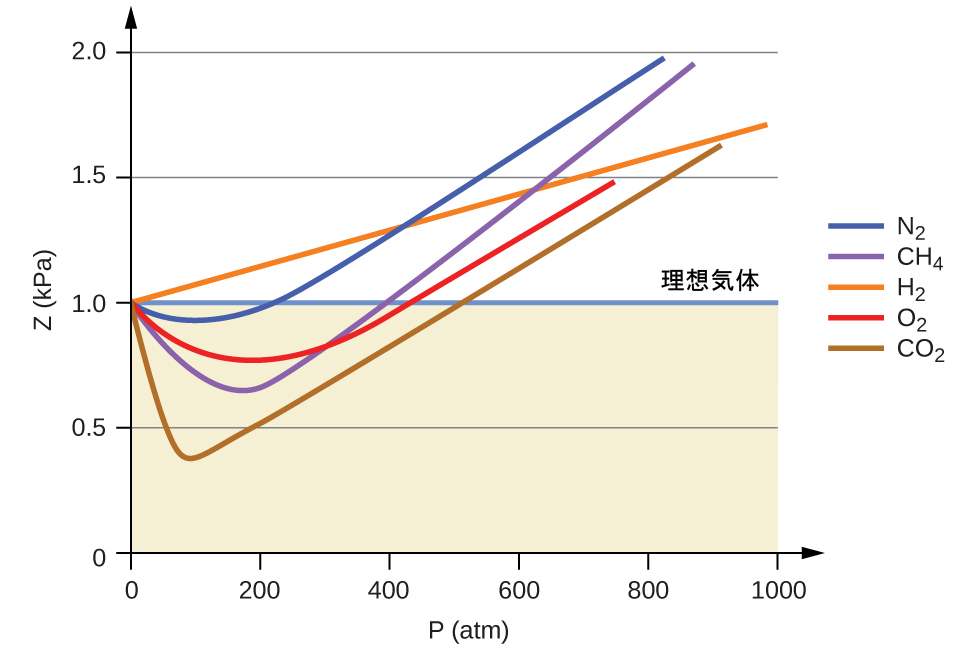
図9.35 | 圧縮率因子(Z)と圧力のグラフは、さまざまな気体が、理想気体の法則によって予測される振る舞いからかなり逸脱することを示しています。
図9.35から明らかなように、理想気体の法則は比較的高い圧力での気体の振る舞いをうまく記述していません。これがなぜそうであるのかを知るために、実際の気体の性質と仮想的な理想気体に期待されていることとの違いを考えてみましょう。
仮想的な理想気体の粒子は、大きな体積を持っておらず、互いに引き寄せ合ったり反発したりしません。一般的に、実際の気体は、比較的低い圧力と高い温度では、おおよそこのような振る舞いをしています。しかしながら、圧力が高くなると、気体の分子がお互いに密集し、分子間の空隙の量が少なくなります。このような高い圧力では、気体分子自体の体積は、気体が占める全体の体積に対してかなりの大きさになります。そのため、高圧になると気体は圧縮されにくくなります。圧力が高くなるにつれてその体積は減少していきますが、この減少はボイルの法則によって予測されるように比例するものではありません。
比較的低い圧力では、気体分子は(平均的に)非常に離れているため、互いに引き合う力は実質的にほとんどなく、ほぼ理想気体の粒子のような振る舞いをします。しかしながら、より高い圧力では、引力ももはや取るに足らないものではありません。この力が分子を少しずつ近くに引き寄せ、圧力を少し下げたり(体積が一定の場合)、体積を減らしたり(圧力が一定の場合)します(図9.36)。この変化は低温でより顕著になります。なぜなら、低温では分子が引力と比べて低いKEを持っているので、そのKEでは分子同士が衝突した後に引力を振り切るのにはあまり効果がないからです。
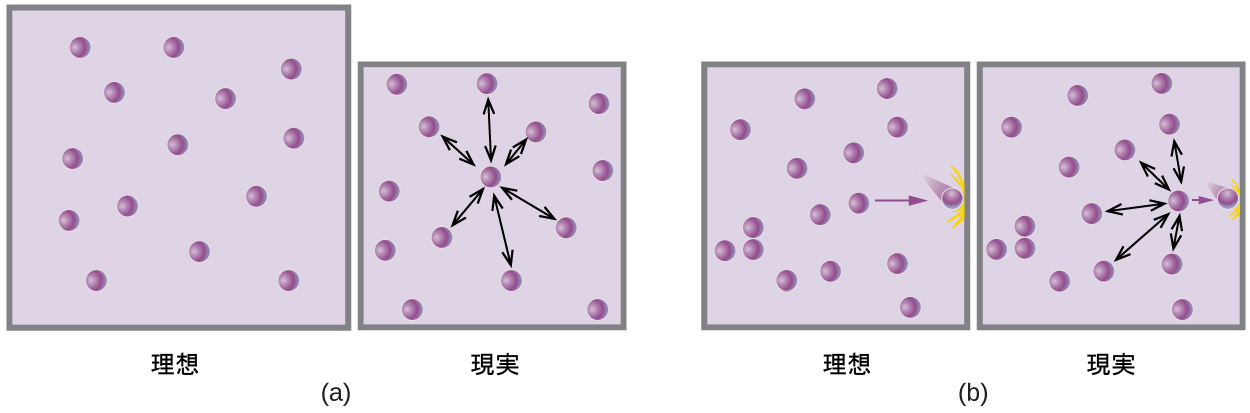
図9.36 | (a)気体分子間の引力は、分子に引力が働かない理想気体に比べて、定圧での気体の体積を減少させる働きをします。(b)これらの引力は、分子と容器の壁との間の衝突の力を減少させるので、理想気体に比べて一定の体積での圧力を減少させます。
理想気体の法則よりも気体の振る舞いをよりよく近似するいくつかの異なる方程式があります。これらのうち最初のものであり最も単純なものは、1879年にオランダの科学者ヨハネス・ファン・デル・ワールスによって開発されました。ファン・デル・ワールス方程式は、2つの項を追加することによって、理想気体の法則を改良したものです:1つは気体分子の体積を説明するためのもので、もう1つは気体分子の間の引力を説明するためのものです。

定数aは特定の気体の分子間の引力の強さに対応し、定数bは特定の気体の分子の大きさに対応します。理想気体の法則における圧力項に対する「補正」はn²a/V²であり、体積に対する「補正」はnbです。Vが比較的大きく、nが比較的小さい場合、これらの補正項はどちらも無視できるほど小さくなり、ファン・デル・ワールス方程式は理想気体の法則であるPV = nRTへと変わることに注意してください。このような条件は、比較的少数の分子が比較的大きな体積を占める気体、すなわち、比較的低い圧力の気体に対応しています。いくつかの一般的な気体についてのファン・デル・ワールス定数の実験値が表9.3に示されています。
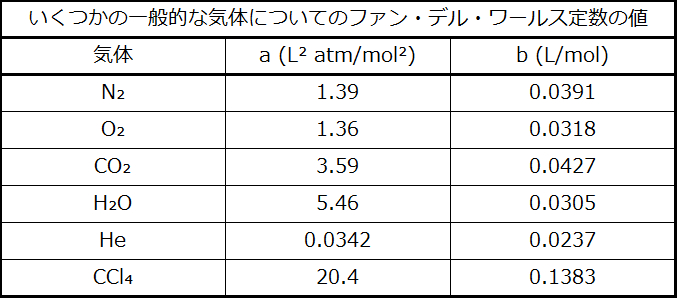
表9.3
低い圧力では、分子間引力の補正aは、分子の体積の補正bよりも重要です。高圧で体積が小さい場合、分子自体が非圧縮性であり、全体の体積のかなりの割合を占めるため、分子の体積についての補正が重要になります。ある程度の中間的な圧力では、2つの補正は反対の影響を及ぼし、気体は圧力についての狭い範囲ではPV = nRTによって与えられる関係に従うように見えます。この振る舞いは、図9.35に示されているいくつかの圧縮率曲線における「へこみ」に反映されています。圧力が大きくなるにしたがって、最初は分子間の引力によって、気体は理想気体よりも圧縮性が高くなります(Pの増加とともにZは減少します)。非常に高い圧力では、気体分子が気体の全体の体積の中で大きな割合を占めるようになるため、気体は圧縮性が低くなります(Pの増加とともにZは増加します)。
厳密に言えば、気体分子間の分子間引力が無視できるほど小さく、気体分子自体が全体の体積のかなりの部分を占めていない場合、理想気体の方程式はうまく機能します。これらの条件は、低圧、高温の条件下で満たされます。このような条件下では、気体は理想的な振る舞いをすると言われ、気体の法則からの逸脱は無視できるほど小さいものです。しかしながら、実際にはそうではないことがしばしばあります。
例題9.24 理想気体の法則とファン・デル・ワールス方程式の比較
4.25Lのフラスコには、229°Cで3.46molのCO₂が入っています。このCO₂の試料の圧力を計算してください:
(a)理想気体の法則から計算してください。
(b)ファン・デル・ワールス方程式から計算してください。
(c)その違いの理由を説明してください。
解法
(a)理想気体の法則から:
\[ P =\frac{nRT}{V}=\rm \frac{3.46\ mol × 0.08206\ L\ atm\ mol^{−1} K^{−1} × 502\ K}{4.25\ L}= 33.5\ atm \]
(b)ファン・デル・ワールス方程式から:
\[ \left(P +\frac{n^2 a}{V^2}\right) × (V − nb) = nRT ⟶ P =\frac{nRT}{(V − nb)}−\frac{n^2 a}{V^2}\\ P =\rm \frac{3.46\ mol× 0.08206\ L\ atm\ mol^{−1}\ K^{−1} × 502\ K}{(4.25\ L − 3.46\ mol× 0.0427\ L\ mol^{−1})}−\frac{(3.46\ mol)^2 × 3.59\ L^2\ atm\ mol^2}{(4.25\ L)^2} \]
これは最終的にP = 32.4atmとなります。
(c)これは、理想気体の法則からの値とあまり変わりません。なぜなら、圧力があまり高くなく、温度もあまり低くないからです。CO₂分子は分子間にある程度の体積と引力を持っているのに対し、理想気体の法則では気体は体積も引力も持っていないと仮定しているため、両方の値はやや異なっています。
学習内容の確認
560mLのフラスコに145 °Cで21.3gのN₂が入っています。N₂の圧力を計算してください:
(a)理想気体の法則から計算してください。
(b)ファン・デル・ワールス方程式から計算してください。
(c)その違いの理由を説明してください。
解答:(a)46.562atm、(b)46.594atm、(c)ファン・デル・ワールス方程式は気体分子自体の体積とともに、分子間引力も考慮しています。
重要用語
絶対零度:シャルルの法則に従うと気体の体積がゼロになるであろう温度
アモントンの法則(または、ゲイ-リュサックの法則):所与のモル数の気体の圧力は、体積が一定に保持されているとき、そのケルビン温度に正比例する
気圧(atm):圧力の単位、1 atm = 101,325 Pa
アボガドロの法則:一定の温度と圧力での気体の体積は、気体分子の数に比例する
バール(barまたはb):圧力の単位、1bar=100,000Pa
気圧計:大気圧を測定するために使われる装置
ボイルの法則:一定の温度に保持された所与のモル数の気体の体積は、測定される際の圧力に反比例する
シャルルの法則:所与のモル数の気体の体積は、圧力が一定に保持されているとき、そのケルビン温度に正比例する
圧縮率因子(Z):理想気体の方程式から計算されたモル体積と、実験によって測定された気体のモル体積との比率
分圧についてのドルトンの法則:理想気体の混合物の合計の圧力は、構成する気体の分圧の合計に等しい
拡散:相対的に高い濃度の領域から相対的に低い濃度の領域への原子または分子の移動(この章では気体の種に関して論じているが、どのような相の種にも適用可能)
浸出:気体の原子や分子が非常に小さな開口部を通って容器から真空中に移動すること
浸出についてのグレアムの法則:気体の拡散率と浸出率は、気体の分子量の平方根に反比例する
静水圧:重力によって流体にかかる圧力
理想気体:物理的性質が気体の法則によって完全に記述される仮想的な気体
理想気体定数(R):理想気体の方程式から導かれる定数 R = 0.08206 L atm mol⁻¹ K⁻¹ または 8.314 L kPa mol⁻¹ K⁻¹
理想気体の法則:単純な気体の法則を組み合わせることによって導き出される条件下での気体の圧力、体積、量、および温度の関係
分子運動論:単純な原理と仮定に基づく理論で、理想気体の振る舞いを効果的に説明することができる
マノメーター:容器内に閉じ込められた気体の圧力を測定するために使われる装置
平均自由行程:分子が衝突と衝突の間に移動する平均距離
モル分率(X):混合物のすべての成分の総モル数に対する混合物のある成分のモル量の比率として定義される濃度の単位
分圧:混合物中の個々の気体が及ぼす圧力
パスカル(Pa):圧力のSI単位、1 Pa = 1 N/m²
1平方インチあたりポンド(psi):米国で一般的な圧力の単位
圧力:単位面積あたりにかかる力
拡散率:ある時間内にある面積を通って拡散する気体の量
二乗平均平方根速度(urms):二乗平均速度の平方根として計算された、一群の粒子の平均速度の尺度
温度と圧力の標準条件(STP):273.15 K(0 °C)と1 atm(101.325 kPa)
標準モル体積:STPでの1モルの気体の体積で、理想的に振る舞う気体の場合は約22.4L
torr:圧力の単位、1torr = 1/760 atm
ファン・デル・ワールス方程式:理想気体の方程式の修正版で、非理想気体の振る舞いを考慮した追加の項を含む
水の蒸気圧: 特定の温度で密閉された容器内で液体の水と平衡にある水蒸気によって及ぼされる圧力
重要な方程式
\(•P =\frac{F}{A}\)
\(•p = hρg\)
\(•PV = nRT\)
\(•P_{Total} = P_A + P_B + P_C + ... = Σ_i P_i\)
\(•P_A = X_A × P_{Total} \hspace{10pt} ここで \hspace{10pt} X_A =\frac{n_A}{n_{Total}}\)
\(•拡散率 =\frac{ある面積を通過する気体の量}{単位時間}\)
\(•{\rm \frac{Aの浸出率}{Bの浸出率}}=\frac{\sqrt{m_{\rm B}}}{\sqrt{m_{\rm A}}}=\frac{\sqrt{ℳ_B}}{\sqrt{ℳ_A}}\)
\(•u_{\rm rms} = \sqrt{\overline{u^2}} =\sqrt{\frac{u_1^2+ u_2^2+ u_3^2+ u_4^2+ …}{n}}\)
\(•{\rm KE_{avg}} =\frac{3}{2}RT\)
\(•u_{\rm rms} =\sqrt{\frac{3RT}{M}}\)
\(•{\rm Z} =\frac{同じTとPでの気体のモル体積}{同じTとPでの理想気体のモル体積}=\left(\frac{PV_m}{RT}\right)_{測定}\)
\(•\left(P +\frac{n^2 a}{V^2}\right) × (V − nb) = nRT\)
この章のまとめ
9.1 気体の圧力
気体は、圧力(単位面積あたりの力)を及ぼします。気体の圧力は、パスカルやキロパスカルといったSI単位だけでなく、トル、気圧、バールなどの他の多くの単位で表されることがあります。大気圧は気圧計を用いて測定されます。その他の気体の圧力は、いくつかのタイプのマノメーターのいずれかを用いて測定することができます。
9.2 圧力、体積、量、および温度を関係付ける:理想気体の法則
気体の振る舞いは、その性質の実験的な観察に基づいたいくつかの法則によって記述することができます。ある量の気体の圧力は、体積が変化しない限り、その絶対温度に正比例します(アモントンの法則)。ある気体試料の体積は、一定の圧力では絶対温度に正比例します(シャルルの法則)。ある量の気体の体積は、温度が一定に保持されている場合、その圧力に反比例します(ボイルの法則)。温度と圧力が同じ条件下では、同じ体積のすべての気体は同じ数の分子を含みます(アボガドロの法則)。
これらの法則を記述する方程式は、理想気体の法則PV = nRTの特殊なケースです。ここで、Pは気体の圧力、Vはその体積、nは気体のモル数、Tはそのケルビン温度、Rは理想(普遍)気体定数です。
9.3 気体の物質、混合物、反応の化学量論
理想気体の法則は、直接測定された量を気体状の物質や混合物について興味のある性質に関連させるような、多くの便利な方程式を導出するために使用することができます。気体の密度とモル質量の計算を可能にするために、理想気体の方程式を適切に並べ替えることができます。分圧についてのドルトンの法則は、気体状の混合物の測定された気体圧力とその組成を関連付けるために使用することができます。アボガドロの法則は、気体状の反応物や生成物を含む化学反応の化学量論的計算に用いることができます。
9.4 気体の浸出と拡散
気体の原子や分子は空間を自由にランダムに移動します。拡散とは、気体の原子や分子が相対的に濃度の高い領域から相対的に濃度の低い領域に移動するプロセスです。浸出とは、気体の種が容器から非常に小さな開口部を通って真空に移動する同様のプロセスです。気体の浸出率は、それらの密度の平方根または原子/分子の質量の平方根に反比例します(グレアムの法則)。
9.5 分子運動論
分子運動論は、理想気体の振る舞いを効果的に説明する、シンプルであるものの非常に効果的なモデルです。この理論では、気体は、体積が無視できるような分子が広く離れるようにして構成されており、分子は一定の運動をしており、絶対温度によって決まる平均速度で弾性的に互いに衝突したり、容器の壁に衝突したりしていると仮定しています。気体の個々の分子はさまざまな速度を示し、その速度の分布は気体の温度と分子の質量に依存します。
9.6 非理想気体の振る舞い
気体分子は有限の体積を持ち、互いに引き合う力を及ぼします。その結果、気体の振る舞いは理想気体の法則では必ずしもうまく説明できません。低圧・高温の条件下では、これらの要因は無視できるほど小さく、理想気体の方程式は気体の振る舞いを正確に記述しており、気体は理想的な振る舞いを示すと言われます。しかしながら、低温・高圧になると、有限の分子サイズと引力を考慮に入れるために、分子の体積や分子の引力の補正が必要になります。ファン・デル・ワールス方程式は、理想気体の法則を修正したもので、これらの条件下での気体の非理想的な振る舞いを説明するために使用することができます。
練習問題
9.1 気体の圧力
1.なぜ鋭い包丁の方が鈍い包丁よりも切れ味が良いのでしょうか?(ヒント:圧力の定義を考えてみてください。)
2.小さな橋の中には、渡る車の車輪や車軸の数によって決まる重量制限を持つものがありますが、これはなぜですか?
3.薄く凍った池を歩いて渡るよりも、転がったり、這っていったりした方がいいのはなぜですか?
4.カリフォルニア州レディングにおける典型的な大気圧は約750mm Hgです。この大気圧をatm単位とkPa単位で計算してください。
5.コロラド州デンバーにおける典型的な大気圧は615 mm Hgです。この圧力は、atm単位とキロパスカル単位では何になりますか?
6.カンザスシティーにおける典型的な大気圧は740torrです。この圧力は、atm単位、水銀柱ミリメートル単位、キロパスカル単位では何になりますか?
7.カナダのタイヤ空気圧ゲージはキロパスカル単位で表示されています。そのようなゲージのどの数値が32psiに相当しますか?
8.バイキングが火星に着陸したときの大気圧は、平均で約6.50ミリバール(1バール=0.987atm)であると測定されました。その圧力は、torr単位とkPa単位では何になりますか?
9.金星の表面の大気の圧力は約88.8atmです。psiで表したその圧力を、psiで表した海面における地球の通常の圧力と比較してください。
10.ある医学検査機器のカタログには、気体のシリンダー内の圧力が14.82MPaと記載されています。この気体の圧力は、atm単位とtorr単位では何になりますか?
11.このシナリオを考えて、以下の質問に答えてください:米国北東部の8月中旬のある日、地元の新聞に以下のような情報が載っていました:海面での大気圧は29.97 in. Hg、1013.9 mbar。
(a)この圧力はkPa単位では何でしたか?
(b)アメリカ北東部の海岸付近の気圧は、通常30.0 in. Hg近くとして報告されています。ハリケーンの時には、この圧力は28.0 in. Hg近くまで下がることがあります。圧力の低下をtorr単位で計算してください。
12.気圧計やマノメーターに不揮発性の液体を使用する必要があるのはなぜですか?
13.海面での気体の試料の圧力を端部閉鎖型マノメーターで測定します。マノメーターの中の液体は水銀です。気体の圧力を以下の単位で求めてください:
(a)torr
(b)Pa
(c)bar
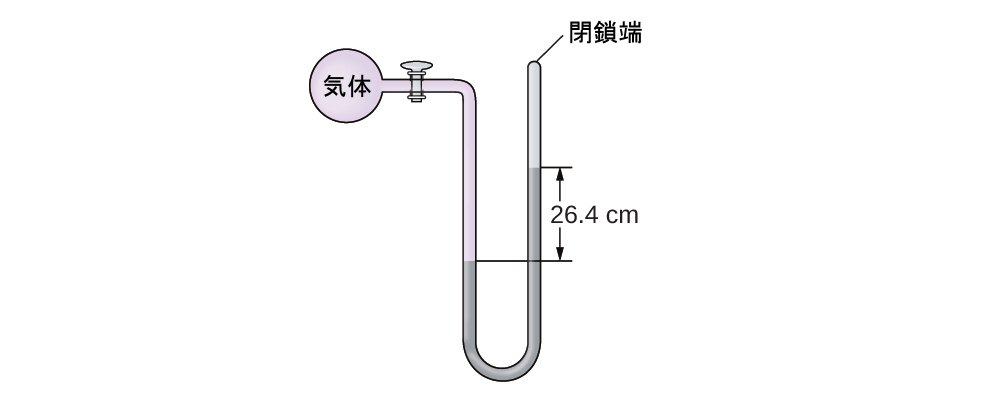
14.気体の試料の圧力を端部開放型マノメーター(右部分に示されているように)で測定します。マノメーターの中の液体は水銀です。大気圧をin. Hgと仮定して、気体の圧力を以下の単位で求めてください:
(a)torr
(b)Pa
(c)bar
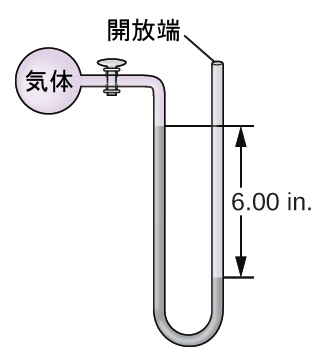
15.海面での気体の試料の圧力を端部開放型水銀マノメーターで測定します。大気圧を760.0mm Hgと仮定して、気体の圧力を以下の単位で求めてください:
(a)mm Hg
(b)atm
(c)kPa
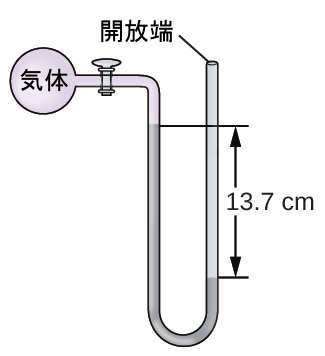
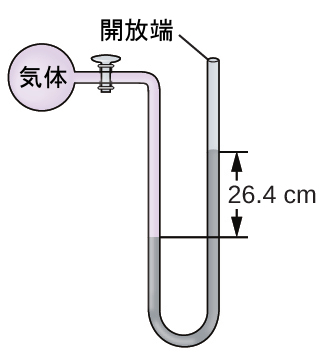
16.海面での気体の試料の圧力を端部開放型水銀マノメーターで測定します。大気圧を760.0mm Hgと仮定して、気体の圧力を以下の単位で求めてください:
(a)mm Hg
(b)atm
(c)kPa
17.揮発性液体を使用すると、端部開放型マノメーターと端部閉鎖型マノメーターを用いた気体の測定にどのような影響を与えるでしょうか?
9.2 圧力、体積、量、および温度を関係付ける:理想気体の法則
18.暑い日に自転車を日なたに放置していると、タイヤが破裂することがあります。これはなぜでしょうか?
19.スキューバダイバーが吐き出した泡(図9.16)の体積が、水面へ向けて上がるにつれてどのように変化するかを説明してください。泡はかたまりのままであると仮定してください。
20.ボイルの法則を述べるひとつの方法として、「他のすべてのものが等しいならば、気体の圧力はその体積に反比例する」というものです。(a)「反比例」という言葉の意味は何ですか?(b)等しくなければならない「他のもの」とは何ですか?
21.アボガドロの法則を述べる別の方法は、「他のすべてのものが等しいならば、気体中の分子の数は気体の体積に正比例する」というものです。(a)「正比例」という言葉の意味は何ですか?(b)等しくなければならない「他のもの」とは何ですか?
22.図9.12のグラフは、曲線の決定に用いた試料中の気体のモル数を2倍にした場合、どのように変化するでしょうか?
23.図9.13のグラフは、曲線の決定に用いた試料中の気体のモル数を2倍にした場合、どのように変化するでしょうか?
24.図9.13のデータに加えて、グラフを決定するために使用した空気の試料の質量を求めるために必要な他の情報は何でしょうか?
25.図9.12を用いて、150K、1atmでの1molのCH₄気体の体積を決定してください。
26.体積が12.5 mLのとき、図9.13に示されるシリンジ内の気体の圧力を、以下を用いて決定してください:
(a)適切なグラフ
(b)ボイルの法則
27.スプレー缶は、噴霧剤のガス(23°Cで1344torrの圧力を持ちます)以外が空になるまで使用します。もしこの缶を火の中(T = 475 °C)に放り込んだ場合、熱い缶の中の圧力はどれだけになりますか?
28.一酸化炭素(CO)の試料が、55°C、744torrで13.3Lの体積を占める場合、744torrで11.2Lのこの試料の温度は何ですか?
29.–196 °Cで測定した2.50Lの体積の水素を100°Cに温めました。圧力が変化しないと仮定して、温度が高くなったときのこの気体の体積を計算してください。
30.息を3回吹き込んで膨らませた風船の体積は1.7Lです。同じ温度と圧力で、同じ大きさの息をさらに5回加えた場合の風船の体積は何ですか?
31.気象観測気球には8.80モルのヘリウムが含まれており、地上での圧力は0.992atm、温度は25°Cです。この条件下での気球の体積は何ですか?

32.ある自動車用エアバッグの体積は、25°Cで77.8gの窒素気体で膨らませたときに66.8Lでした。このエアバッグの中の圧力はkPa単位で何ですか?
33.圧力が1.220atmの場合、788.0Kで4.3410Lの容器の中には何モルの気体状の三フッ化ホウ素(BF₃)が含まれていますか?BF₃のグラム数は何ですか?
34.ヨウ素(I₂)は室温では固体ですが、温めると昇華(固体から気体に変化)します。0.462atmの圧力で0.292gのI₂蒸気を含む73.3mLの容器の中の温度は何ですか?
35.以下の場合では、それぞれ何グラムの気体が存在するでしょうか?
(a)307 torr、26 °Cで、0.100 LのCO₂の場合
(b)378.3 kPa、483 Kで、8.75 LのC₂H₄の場合
(c)0.23 torr、-54°Cで、221 mLのArの場合
36.ある高高度気球は、21°Cの温度と745torrの圧力で、1.41×10⁴Lの水素で満たされています。温度が-48°Cで圧力が63.1torrである高度20kmの高さでは、この気球の体積は何ですか?
37.医療用酸素シリンダーの体積は35.4Lであり、151atmの圧力、25°Cの温度でO₂が入っています。これは、通常の体の状態、つまり1atm、37°Cで、どれだけの体積のO₂に相当しますか?
38.体積18Lの大型スキューバタンク(図9.16)は、220barの圧力用に分類されています。このタンクの中に、2.37atmの圧力(水深45フィート)でダイバーに1860Lの空気を供給するのに十分な量の空気が、20°Cで入れられました。タンクは20°Cで容量いっぱいにまで充填されましたか?
39.11.34kgのブタン(C₄H₁₀)を含む20.0Lのシリンダーを大気に開放しました。シリンダーを開けて、シリンダー内の圧力が大気圧0.983atm、温度27°Cになるまで気体を逃がした場合、シリンダー内に残っている気体の質量を計算してください。
40.平均的な70kgの人間の男性は、安静時に、25°C、100kPaで1時間あたり14Lの純粋なO₂を消費します。70kgの男性が1.0時間安静にしている間に、何モルのO₂を消費しますか?
41.理想的な振る舞いを示す所与の量の気体について、以下のもののラベル付きのグラフを描いてください:
(a)Vに対するPの変化
(b)Tに対するVの変化
(c)Tに対するPの変化
(d)Vに対する1/Pの変化
42.STPで1リットルのメタン気体(CH₄)は、STPで1リットルの純粋な水素気体(H₂)よりも多くの水素原子を含んでいます。アボガドロの法則を出発点として、その理由を説明してください。
43.オゾン層の減少に対するフロン類(CCl₂F₂など)の影響はよく知られています。フロン類の代わりにCH₃CH₂F(g)のような代替物質を使用することで、この問題は大きく改善されました。STPでこれらのそれぞれの化合物10.0 gが占める体積を計算してください:
(a)CCl₂F₂(g)
(b)CH₃CH₂F(g)
44.放射性元素ラジウム1gが1年かけて崩壊すると、1.16×10¹⁸個のアルファ粒子(ヘリウム原子核)が生じます。それぞれのアルファ粒子がヘリウム気体の原子になります。生成されたヘリウム気体が25°Cの温度で125mLの体積を占める場合、その圧力はパスカル単位で何になりますか?
45.21°C、0.981atmで100.21Lの体積の気球が放出され、ブリティッシュコロンビア州のクランピット山の頂上をかろうじて通過しました。もし温度が5.24°Cで、気球の最終的な体積が144.53Lの場合、気球がクランピット山を通過するときの圧力は何でしょうか?
46.一定の体積で、一定量の気体の温度を2倍にすると、圧力には何が起こるでしょうか?
47.一定の温度で、一定量の気体の体積を3倍にすると、圧力には何が起こるでしょうか?
9.3 気体の物質、混合物、反応の化学量論
48.温度325 K、圧力113.0 kPaでの笑気ガスの一酸化二窒素(N₂O)の密度は何ですか?
49.30.0°C、0.954atmでのFreon-12(CCl₂F₂)の密度を計算してください。
50.乾燥した空気と水蒸気で飽和した空気とでは、同じ温度と圧力では、どちらが密度が高いですか?説明してください。
51.肺気腫の患者が呼吸をするために使用するO₂(g)のシリンダーの体積は3.00L、圧力は10.0atmです。シリンダーの温度が28.0°Cの場合、シリンダー内の酸素の質量は何ですか?
52.0.0494gの気体が、温度26°C、圧力307torrで0.100Lの体積を占めるとしたら、気体のモル質量は何ですか?
53.0.281gの気体が、温度126°C、圧力777torrで125mLの体積を占めるとしたら、気体のモル質量は何ですか?
54.プロペンの分子式がCH₂ではなく、C₃H₆であることを実験的に示すにはどうしたらよいですか?
55.ある特定の気体状のリンのフッ化物の密度は、STPで3.93g/Lです。このフッ化物のモル質量を計算し、その分子式を決定してください。
56.この問題を考えてください:ある化合物は、39%のC、45%のN、および16%のHを含みます。この化合物0.157 gが、22 °C、99.5 kPa の圧力で125 mLを占める場合、この化合物の分子式は何ですか?
(a)問題に答えるために必要な手順を概説してください。
(b)問題に答えてください。
57.医療研究機関の血液ガス分析装置の校正に使用される36.0Lのシリンダーには、350gのCO₂、805gのO₂、4880gのN₂が入っています。25°Cの場合、シリンダー内の圧力は何atmですか?
58.医療研究機関の血液ガス分析装置の校正に使用される混合気体のシリンダーは、全体の圧力が146atmで、5.0%のCO₂、12.0%のO₂、残りにN₂を含んでいます。この気体のそれぞれの成分の分圧は何ですか?(与えられているパーセントは、それぞれ成分による全体の圧力の割合を示しています。)
59.未精製の石油から分離された気体の試料は、全体の圧力が307.2kPaで、90.0%のCH₄、8.9%のC₂H₆、および1.1%のC₃H₈を含んでいます。この気体のそれぞれの成分の分圧は何ですか?(与えられているパーセントは、それぞれ成分による全体の圧力の割合を示しています。)
60.0.200 gのH₂、1.00 gのN₂、0.820 gのArからなる混合物が、STPで密閉された容器に保管されています。気体が理想的な振る舞いを示すと仮定して、容器の体積を決定してください。
61.水素気体と酸素気体の混合物は、ほとんどが爆発性です。しかしながら、3.0%未満のO₂を含む混合物は、爆発性ではありません。33.2atmのH₂シリンダーに十分な量のO₂を加えて全体の圧力を34.5atmにした場合、その混合物は爆発性ですか?
62.市販の水銀蒸気分析装置では、空気中の気体状のHg原子(有毒です)の濃度を、2×10⁻⁶mg/Lという低濃度まで検出できます。26°Cで大気圧が733torrである場合、この濃度では、気体状の水銀の分圧は何ですか?
63.一酸化炭素の試料を、全体の圧力756torr、温度18°Cで水上置換により捕集しました。一酸化炭素の圧力は何ですか?(水の蒸気圧は表9.2を参照してください。)
64.一般的な化学実験室での実験で、ある学生が水上置換により気体の試料を捕集しました。この気体の体積は265 mL、圧力は753 torr、温度は27 °Cでした。気体の質量は 0.472 g でした。この気体のモル質量は何ですか?
65.ジョゼフ・プリーストリーは、酸化水銀HgOを加熱することにより、初めて純粋な酸素を調製しました:
2HgO(s) ⟶ 2Hg(l) + O₂(g)
(a)以下の問題に答えるために必要な手順を概説してください:5.36gのHgOの分解により、23°C、0.975atmでどれだけの体積のO₂が生成されますか?
(b)問題に答えてください。
66.キャベンディッシュは1766年に赤熱した砲身に蒸気を通すという斬新な方法によって水素を調製しました:
4H₂O(g) + 3Fe(s) ⟶ Fe₃O₄(s) + 4H₂(g)
(a)以下の問題に答えるために必要な手順を概説してください:15.O gのH₂Oの反応から、745 torr、温度20°Cでどれだけの体積のH₂が生成されますか?
(b)問題に答えてください。
67.クロロフルオロカーボンCCl₂F₂は、水素と反応して化学物質製造に有用な化合物であるCH₂F₂(g)を生成することにより、別の化合物にリサイクルすることができます:
CCl₂F₂(g) + 4H₂(g) ⟶ CH₂F₂(g) + 2HCl(g)
(a)以下の問題に答えるために必要な手順を概説してください:1トン(1.000×10³kg)のCCl₂F₂と反応させるには、225atm、35.5°Cでどれだけの体積の水素が必要ですか?
(b)問題に答えてください。
68.自動車のエアバッグは、固体のアジ化ナトリウム(NaN₃)の分解によって生成される窒素気体で膨らませています。他の生成物は金属ナトリウムです。125gのアジ化ナトリウムの分解によって生成された27°C、756torrでの窒素気体の体積を計算してください。
69.石灰CaOは、炭酸カルシウムCaCO₃を加熱することにより生成します。他の生成物は二酸化炭素です。
(a)以下の問題に答えるために必要な手順を概説してください:1トン(1.000×10³kg)の炭酸カルシウムを分解すると、875 K、0.966 atm でどれだけの体積の二酸化炭素が生成されますか?
(b)問題に答えてください。
70.小型電池が利用できるようになる前は、自転車のライトにカーバイドランプが使われていました。炭化カルシウム(CaC₂)と水を反応させることにより、アセチレン気体(C₂H₂)と、固体の水酸化カルシウムが生成されました。このアセチレン気体の着火により点灯しました。現在では、同じランプが一部の洞窟探検家によって使用されており、また、カーバイドキャノン用のアセチレンの製造にも炭化カルシウムが使用されています。
(a)以下の問題に答えるために必要な手順を概説してください:15.48gのCaC₂と水を反応させると、1.005 atm、12.2 °Cでどれだけの体積のC₂H₂が生成されますか?
(b)問題に答えてください。
71.温度と圧力が同じ条件下でC₂H₆とO₂の体積が測定される場合、12.00 Lのエタン気体C₂H₆を燃焼させて二酸化炭素と水を生成するのに必要な酸素の体積を計算してください。
72.STPで8.0 LのNOをNO₂に酸化するためには、STPでどれだけの体積のO₂が必要ですか?STPでどれだけの体積のNO₂が生成されますか?
73.以下の問題を考えてください:
(a)STPで測定された1.00 LのC₂H₆(g)を燃焼させることによって生成されたCO₂(g)とH₂O(g)の合計の体積は、600 °C、0.888 atmでどれだけですか?
(b)生成物の気体中のH₂Oの分圧は何ですか?
74.メタノール(CH₃OH)は以下の反応により工業的に製造されます:
\(\rm CO\ (g) + 2H_2\ (g) \xrightarrow{銅触媒300°C、300atm} CH_3OH\ (g)\)
気体が理想気体として振る舞うと仮定して、最終的な体積に対する反応物の合計の体積の比率を求めてください。
75.129.7gのBaO₂をBaOとO₂に分解すると、423.0 K、127.4 kPaの圧力でどれだけの体積の酸素が生成されますか?
76.STPで2.50Lの無色の気体の試料を分解すると、STPで2.50LのN₂と1.25LのO₂が得られました。この無色の気体は何ですか?
77.エタノール(C₂H₅OH)は、工業的にはエチレン(C₂H₄)から以下のような一連の反応によって製造されます:
3C₂H₄ + 2H₂SO₄ ⟶ C₂H₅HSO₄ + (C₂H₅)₂SO₄
C₂H₅HSO₄ + (C₂H₅)₂SO₄ + 3H₂O ⟶ 3C₂H₅OH + 2H₂SO₄
全体でのエタノールの収率が90.1%の場合、1.000トン(1000kg)のエタノールを生産するためには、STPでどれだけの体積のエチレンが必要ですか?
78.ヘモグロビン1分子は酸素4分子と結合します。体温(37°C)、圧力743torrで、1.0gのヘモグロビンと1.53mLの酸素が結合する場合、ヘモグロビンのモル質量は何ですか?
79.キセノンとフッ素の化合物の試料を18torrの圧力で容器に閉じ込めました。この容器の中に、圧力が72torrになるまで水素を加えました。この混合物に電気火花を通すと、XeとHFが生成されました。HFを固体のKOHと反応させて除去すると、容器の中のキセノンと未反応の水素の最終的な圧力は36torrでした。元の試料に含まれるフッ化キセノンの経験式は何ですか?(注:フッ化キセノンは1分子に1個のキセノン原子しか含まれていません。)
80.アミノ酸の分析方法の1つにヴァン・スライク法があります。タンパク質に含まれる特徴的なアミノ基(-NH₂)は、亜硝酸(HNO₂)と反応してN₂気体を生成します。この気体の体積からアミノ酸の量を求めることができます。グリシン(CH₂(NH₂)COOH)を含む生体試料0.0604gをヴァン・スライク法で分析したところ、735 torrの圧力と29 °Cでの水上置換の捕集により3.70mLのN₂が得られました。試料中のグリシンの割合は何%ですか?
CH₂(NH₂)CO₂H + HNO₂ ⟶ CH₂(OH)CO₂H + H₂O + N₂
9.4 気体の浸出と拡散
81.ヘリウム気体を充填した風船は、元の体積の50%にしぼむまで6時間かかります。同じ体積の水素気体を(ヘリウムの代わりに)充填した同じ風船の体積が50%減るまでには、どれだけの時間がかかるでしょうか?
82.図9.27の中央の図に示されている右側と左側の容器で、分子の数が同じではない理由を説明してください。
83.浸出率の定義、および速度とモル質量とを関係付けるグレアムの発見から始めて、2つの気体の相対的な浸出率とそれらの分子質量とを関係付けるグレアムの法則の式の導出方法を示してください。
84.重水D₂O(モル質量 = 20.03 g mol⁻¹)は、気相中の分子の相対的な拡散率の違いの結果として、通常の水H₂O(モル質量=18.01)から分離することができます。H₂OとD₂Oの相対的な拡散率を計算してください。
85.以下の気体のうち、酸素よりもゆっくりと拡散するものはどれですか?F₂、Ne、N₂O、C₂H₂、NO、Cl₂、H₂S
86.ウラン濃縮のための気体の拡散の議論の中で、²³⁵UF₆は²³⁸UF₆よりも0.4%早く拡散すると述べました。この値を裏付ける計算を示してください。²³⁵UF₆のモル質量は 235.043930 + 6 × 18.998403 = 349.034348 g/mol、²³⁸UF₆のモル質量は 238.050788 + 6 × 18.998403 = 352.041206 g/mol です。
87.²H₂(モル質量4.0 g/mol)と比較した¹H₂(モル質量2.0 g/mol)の相対的な拡散率と、O₃(モル質量48 g/mol)と比較したO₂(モル質量32 g/mol)の相対的な拡散率を計算してください。
88.二酸化炭素が102 mL/sの率で拡散する拡散装置の中で、正体が不明の気体が83.3 mL/sの率で拡散しました。この未知の気体の分子量を計算してください。
89.長さ87.0cmのガラス管のそれぞれの端部に、アンモニアで湿らせた綿棒と塩酸で湿らせた綿棒を同時に挿入すると、気体のNH₃と気体のHClが最初に接触するところにNH₄Clの白いリングが形成されます。NH₃(g) + HCl(g)⟶ NH₄Cl(s)アンモニアで湿らせたプラグからおよそどのくらいの距離でこれが起こりますか? (ヒント:NH₃とHClの両方の拡散率を計算して、NH₃がHClよりもどれだけ速く拡散するかを調べてください。)
9.5 分子運動論
90.分子運動論の仮定を用いて、気体はどのような形の容器であっても均一に満たす理由を説明してください。
91.気体中のある分子の速度は、一定の温度で2倍になることがありますか?あなたの答えを説明してください。
92.以下のように条件を変えたとき、理想気体の分子の平均運動エネルギーはどうなるかを記述してください:
(a)一定の温度で、体積を小さくすることにより気体の圧力を上げる。
(b)一定の体積で、温度を上げることにより気体の圧力を上げる。
(c)分子の平均速度を2倍にする。
93.ヘリウムの試料中の分子の速度分布が図9.34に示されています。この試料を冷却した場合、速度分布はH₂とH₂Oのどちらに似るようになるでしょうか?あなたの答えを説明してください。
94.SO₂とO₂の気体の混合物におけるSO₂分子の平均運動エネルギーとO₂分子の平均運動エネルギーの比率は何ですか?2つの気体の二乗平均平方根速度urmsの比率は何ですか?
95.最初にSTPにある1LのCOの試料を546Kに加熱し、その体積を2Lに増加させました。
(a)これらの変化は、容器の壁の単位面積あたりの気体分子の衝突回数にどのような影響を与えますか?
(b)分子の平均運動エネルギーにはどのような影響がありますか?
(c)分子の二乗平均平方根速度にはどのような影響がありますか?
96.25°CでのH₂分子の二乗平均平方根速度は約1.6km/sです。25°CでのN₂分子の二乗平均平方根速度は何km/sですか?
97.以下の問題に答えてください:
(a)本章の冒頭に示されている熱気球内の気体の圧力は、気球の外側の大気の圧力よりも大きいですか、小さいですか、あるいは等しいですか?
(b)本章の冒頭に示されている熱気球内の気体の密度は、気球の外側の大気の密度よりも大きいですか、小さいですか、あるいは等しいですか?
(c)圧力1atm、温度20°Cのとき、乾燥した空気の密度は1.2256g/Lです。乾燥した空気の(平均)モル質量は何ですか?
(d)熱気球の中の気体の平均温度は 1.30 × 10² °F です。気体のモル質量が乾燥した空気のモル質量と等しいと仮定して、その密度を計算してください。
(e)熱気球の揚力は、気球によって押しのけられた冷たい空気の質量と気球の中の気体の質量との差に等しいです。(c)の冷たい空気1.00Lの質量と、(d)の暖かい空気1.00Lの質量の差は何ですか?
(f)平均的な気球は60フィートの直径と1.1×10⁵立方フィートの体積を持っています。このような気球の揚力は何ですか?気球とその支持材の重量が500ポンドである場合、乗客や貨物を運ぶための揚力はどれだけになりますか?
(g)気球は40.0ガロンの液体プロパン(密度0.5005g/L)を積んでいます。このプロパンの燃焼により発生するCO₂とH₂O気体の体積は何ですか?
(h)気球の飛行時間は約90分です。この時間内にすべての燃料が燃焼された場合、飛行中に気球の中の暖かい空気から失われる熱損失のおおよその割合(単位:kJ/分)は何ですか?
98.気体1の拡散率と気体2の拡散率の比率(R₁/R₂)は0 °Cと100 °Cで同じであることを示してください。
9.6 非理想気体の振る舞い
99.以下は、いくつかの異なる気体の振る舞いを示すグラフです。これらの気体のうち、理想気体で予測される振る舞いとは大きく異なる振る舞いを示すものはどれですか?
100.CO₂のPVを表した図が理想気体のPVを表した図とは異なる理由を説明してください。
101.以下の条件の組み合わせのうち、どの条件下で実際の気体は理想気体と最も似た振る舞いをし、どの条件下で実際の気体は理想気体とは異なる振る舞いをすると予想されますか?説明してください。
(a)高い圧力、小さい体積
(b)高い温度、低い圧力
(c)低い温度、高い圧力
102.実際の気体の振る舞いが理想気体の振る舞いから逸脱する原因となっている因子について記述してください。
103.以下の気体のうち、分子の体積についての補正が最も大きいものはどれですか?:CO、CO₂、H₂、He、NH₃、SF₆
104.0.245Lのフラスコには159°Cで0.467molのCO₂が含まれています。圧力を計算してください:
(a)理想気体の法則を用いて計算してください。
(b)ファン・デル・ワールス方程式を用いて計算してください。
(c)その違いの理由を説明してください。
(d)どちらの補正(PとVのどちらの補正)が優勢であるかを特定し、その理由を明らかにしてください。
105.以下の問題に答えてください:
(a)もしXXが理想気体として振る舞っているとしたら、そのZとPについてのグラフはどのようになるでしょうか?
(b)この章では、ほとんどの場合、気体を理想的なものとして扱って計算を行いました。これは正当化されるでしょうか?
(c)気体分子の体積がZに与える影響は何ですか?この影響はどのような条件下では小さいでしょうか?また、どのような条件下では大きいでしょうか?適切な図を用いて説明してください。
(d)分子間引力がZの値に与える影響は何ですか?この影響はどのような条件下では小さいでしょうか?また、どのような条件下では大きいでしょうか?適切な図を用いて説明してください。
(e)一般的に、どのような温度条件下で、気体のZが理想気体のZから最も大きく逸脱すると予測しますか?
解答のヒント
1.鋭い包丁の刃先は、鈍い包丁に比べて表面積が小さくなっています。圧力は単位面積あたりの力なので、鋭い包丁の方が同じ力でより高い圧力をかけるため、より効果的に材料を切ることができます。
3.横になっていると、立っている場合に比べて、より大きな表面積に体重が分散され、氷にかかる圧力が小さくなります。圧力が小さくなれば、薄い氷を突き破る可能性が低くなります。
5.0.809 atm、82.0 kPa
7.2.2 × 10²kPa
9.地球: 14.7lb in⁻²、金星: 1.30 × 10³lb in⁻²
11.(a)101.5 kPa、(b)51 torrの低下
13.(a)264 torr、(b)35,200 Pa、(c)0.352 bar
15.(a)623 mm Hg、(b)0.820 atm、(c)83.1 kPa
17.端部閉鎖型マノメーターでは、蒸発した液体はマノメーターの管の両側に均等な対向する圧力を与えるので、変化は観察されないでしょう。しかしながら、端部開放型マノメーターでは、P気体 = P大気圧 + P液体の体積なので、予測されるよりも大きな気体の圧力の読み取り値が得られるでしょう。
19.気泡が上昇すると圧力が低下するので、ボイルの法則によって示唆されるように、気泡の体積が増加します。
21.(a)気体中の粒子の数は、体積の増加に伴って増加します。(b)温度、圧力
23.曲線はより右側、より上側に移りますが、基本的な形は同じままでしょう。
25.約12.5 L
27.3.40 × 10³torr
29.12.1 L
31.217 L
33.8.190 × 10⁻²mol、5.553 g
35.(a)7.24 × 10⁻²g、(b)23.1 g、(c)1.5 × 10⁻⁴g
37.5561 L
39.46.4 g
41.理想的に振る舞う気体の場合:
43.(a)1.85 LのCCl₂F₂、(b)4.66 LのCH₃CH₂F
45.0.644 atm
47.圧力は3分の1に低下する。
49.4.64 g L⁻¹
51.38.8 g
53.72.0 g mol⁻¹
55.88.1 g mol⁻¹、PF₃
57.141 atm、107,000 torr、14,300 kPa
59.CH₄:276 kPa、C₂H₆:27 kPa、C₃H₈:3.4 kPa
61.はい
63.740 torr
65.(a)分解するHgOのモル量を決定します。化学反応式を用いて、この量のHgOの分解によって生成されるO₂のモル量を決定します。O₂のモル量、温度、圧力からO₂の体積を決定します。(b)0.308 L
67.(a)CCl₂F₂のモル質量を決定します。バランスの取れた反応式から、完全な反応に必要なH₂のモル量を計算します。理想気体の法則から、H₂のモル量を体積に換算します。(b)3.72 × 10³L
69.(a)式のバランスを取ります。生成されたCO₂のグラムとモル数を決定します。理想気体の法則から、気体の体積を決定します。(b)7.43 × 10⁵L
71.42.00 L
73.(a)18.0 L、(b)0.533 atm
75.10.57 LのO₂
77.5.40 × 10⁵L
79.XeF₂
81.4.2時間
83.浸出は、気体が小さな穴を通って真空へと逃げるプロセスとして定義することができます。グレアムの法則では、2つの気体AとBの混合物では、以下のようになることを述べています:
\[ \rm \left(\frac{Aの率}{Bの率}\right) =\left(\frac{Bのモル質量}{Aのモル質量}\right)^{\frac{1}{2}} \]
AもBも同じ温度で同じ容器に入っているので、同じ運動エネルギーを持つことになります:
\[ {\rm KE_A = KE_B \hspace{20pt} KE} =\frac{1}{2}mv^2\\ したがって\frac{1}{2}m_{\rm A} v_{\rm A}^2=\frac{1}{2}m_{\rm B} v_{\rm B}^2\\ \frac{v_{\rm A}^2}{v_{\rm B}^2}=\frac{m_{\rm B}}{m_{\rm A}}\\ \left(\frac{v_{\rm A}^2}{v_{\rm B}^2}\right)^{\frac{1}{2}}=\left(\frac{m_{\rm B}}{m_{\rm A}}\right)^{\frac{1}{2}}\\ \frac{v_{\rm A}}{v_{\rm B}}=\left(\frac{m_{\rm B}}{m_{\rm A}}\right)^{\frac{1}{2}}\\ \]
85.F₂、N₂O、Cl₂、H₂S
87.1.4、1.2
89.51.7 cm
91.はい。どの任意の瞬間でも、気体の試料の中の分子の速度の値には範囲があります。どの単一の分子も、他の分子と衝突すると速度を上げたり、遅くしたりすることがあります。一定の温度では、すべての分子の平均速度は一定です。
93.H₂O。冷却するとヘリウム原子の速度が遅くなり、あたかもヘリウム原子が重くなったかのような振る舞いをするようになります。
95.(a)容器の壁の単位面積あたりの衝突回数は一定です。(b)平均運動エネルギーは2倍になります。(c)二乗平均平方根速度は初期値の\(\sqrt{2}\)倍に増加します。urmsは\(\rm \sqrt{KE_{avg}}\)に比例します。
97.(a)等しい、(b)小さい、(c)29.48 g/mol、(d)1.0966 g/L、(e)0.129 g/L、(f)4.01 × 10⁵g、正味の揚力 = 384 lb、(g)270 L、(h)39.1 kJ/分
99.気体C、E、F
101.理想気体に最も近い気体の振る舞いは、(b)の条件下で起こるでしょう。分子の速度が速く、衝突と衝突の間の距離が長いです。また、分子は接触時間が短く、相互作用が起こりにくいです。(a)と(c)に記述されている条件では逸脱が生じます。(a)の条件下では、一部の気体が液化することがあります。(c)の条件下では、ほとんどの気体が液化します。
103.SF₆
105.(a)1.0において、直線の水平線となります。(b)実際の気体が低圧・高温のときは、理想気体に十分に近い振る舞いをするので、理想気体として近似できます。しかしながら、高圧・高温では理想気体の近似が崩れて、理想気体の方程式によって計算された圧力とは大きく異なる場合があることがわかります。(c)圧縮率が大きいほど、体積が重要になります。低圧では分子間引力の補正係数が大きくなり、気体分子の体積がZに与える影響は圧縮率を小さく下げることになります。より高い圧力では、Zに対する気体分子自体の体積の効果が圧縮率を増加させるでしょう(図9.35参照)。(d)やはり、低圧では、Zに対する分子間引力の効果は、気体分子自体の体積についての補正係数よりも重要ですが、おそらくまだ小さいでしょう。より高い圧力と低温では、分子間引力の影響は大きくなります。図9.35を参照してください。(e)低温
[1] IUPACの標準圧力の定義は1982年に1atmから1bar(100kPa) に変更されましたが、以前の定義はまだ多くの文献資料で使用されており、この教科書でもそれを使います。
[2] “Quotations by Joseph-Louis Lagrange,” last modified February 2006, accessed February 10, 2015, http://www-history.mcs.st-andrews.ac.uk/Quotations/Lagrange.html
この訳文は元の本のCreative Commons BY 4.0ライセンスに従って同ライセンスにて公開します。問題がありましたら、可能な限り早く対応いたしますので、ご連絡ください。また、誤訳・不適切な表現等ありましたらご指摘ください。この本は、https://openstax.org/details/books/chemistry-2eで無料でダウンロードできます。