第17章 電気化学

図17.1 | 電気自動車は、自発的な酸化-還元反応のエネルギーを利用する装置である電池を動力源としています。(credit: modification of work by Robert Couse-Baker)
この章の概要
17.1 酸化-還元化学の復習
17.2 ガルバニ電池
17.3 電極電位と電池電位
17.4 電位、自由エネルギー、および平衡
17.5 電池と燃料電池
17.6 腐食
17.7 電気分解
はじめに
この教科書の別の章では、酸化-還元(レドックス)反応の化学を紹介しました。この重要な反応分類は、1つかそれ以上の反応元素の酸化状態の変化によって定義されており、反応種間での電子の移動を伴う反応の部分集合を含みます。19世紀への変わり目頃、化学者たちは、これらの電子を酸化-還元反応物の密接な接触を介して直接移動させるのではなく、外部回路を介して間接的に移動させることができる方法を模索し始めました。それ以来2世紀を経て、電気化学の分野は、酸化-還元化学の基本的な側面に関する重要な洞察を得るとともに、産業規模の冶金プロセスから電気自動車用の頑丈で再充電可能な電池に至るまでの豊富な技術を生み出すまでに発展してきました(図17.1)。本章では、電気化学の本質的な概念について述べていきます。
17.1 酸化-還元化学の復習
この節が終わるまでに、あなたは次のことができるようになります:
•酸化-還元化学を特徴付ける性質を記述する
•酸化-還元反応の酸化剤と還元剤を特定する
•半反応法を用いて酸化-還元反応の化学反応式のバランスを取る
電子の移動を伴う反応は電気化学のトピックには不可欠であるので、ここでは酸化-還元化学の簡単な復習を行い、教科書の以前の章(反応の化学量論の章を参照)の内容を要約して拡張します。追加の復習を望む読者は、反応の化学量論の章を参照してください。
酸化数
定義によれば、酸化-還元反応とは、関与する1つかそれ以上の元素の酸化数(または酸化状態)の変化を伴う反応です。ある化合物中の元素の酸化数は、本質的には、純粋な元素の原子と比較した際に、その原子の電子の環境がどのように異なっているかを評価するものです。この説明によると、ある元素の原子の酸化数はゼロに等しいです。化合物がイオン性の場合、化合物中の原子の酸化数は、その化合物中で原子が持つであろう電荷に等しくなります。これらの規則の結果として、ある分子内のすべての原子の酸化数の和は、分子の電荷に等しくなります。この定式化を説明するために、イオン性と共有結合性という2つの化合物の分類の例を検討します。
単純なイオン化合物は、この定式化を説明するための最も単純な例を表しています。なぜなら、定義によって、元素の酸化数はイオン電荷と数値的に等しいからです。塩化ナトリウムNaClは、Na⁺カチオンとCl⁻アニオンで構成されているので、ナトリウムと塩素の酸化数はそれぞれ+1と-1です。フッ化カルシウムCaF₂は、Ca²⁺カチオンとF⁻アニオンで構成されているので、カルシウムとフッ素の酸化数はそれぞれ+2と-1です。
共有結合化合物では、この定式化の使用はより難しいものとなります。水は共有結合化合物で、その分子は2つのH原子が極性共有結合のO-H結合を介して中心のO原子に別々に結合しています。O-H結合を構成する共有電子は、より電気的に陰性なO原子の方へより強く引きつけられるため、水分子の中ではO原子は(元素の酸素としてのO原子と比較して)部分的に負の電荷を獲得します。その結果、水分子中のH原子は、元素の水素としてのH原子と比較して部分的に正の電荷を持つことになります。それぞれの水分子の部分的な負電荷と部分的な正電荷の和はゼロであり、水分子は中性です。
水のO-H結合内の共有電子の分極が100%完全に行われたと想像してみてください。その結果、電子がHからOへと移動し、水はO²⁻アニオンとH⁺カチオンからなるイオン化合物となるでしょう。したがって、水の中の酸素と水素の酸化数はそれぞれ-2と+1となります。この同じ論理を四塩化炭素CCl₄に適用すると、炭素の酸化数は+4、塩素の酸化数は-1となります。硝酸イオンNO₃⁻では、窒素の酸化数は+5、酸素の酸化数は-2となり、これを合計すると分子の1−の電荷に等しくなります:
\[ {\rm (1\ N原子)\left(\frac{+5}{N原子}\right)+ (3\ O原子)\left(\frac{−2}{O原子}\right)= +5 + (−6) = −1}\\ \]
酸化-還元反応式のバランスを取る
以下のバランスの取れていない反応式は、溶融した塩化ナトリウムの分解を記述しています:
\[ {\rm NaCl\ (l) ⟶ Na\ (l) + Cl_2\ (g)\ (バランスが取れていない)}\\ \]
この反応は、Na の酸化数が +1 から 0 に減少し(還元する)、Cl の酸化数が -1 から 0 に増加する(酸化する)ので、酸化-還元分類の基準を満たしています。この場合の反応式は、検査により簡単にバランスが取れるものであり、NaClとNaには化学量論的な係数2が必要とされます:
\[ {\rm 2NaCl\ (l) ⟶ 2Na\ (l) + Cl_2\ (g)\ (バランスが取れている)}\\ \]
水溶液中で起こる酸化-還元反応は電気化学ではよく出会うものであり、その多くは水またはその特徴的なイオンである H⁺(aq) と OH⁻(aq) を反応物や生成物として含むものです。このような場合、酸化-還元反応を表す反応式は、検査によりバランスを取るのが非常に難しく、半反応法と呼ばれる系統的なアプローチを使用することが役に立ちます。このアプローチには、以下のようなステップが含まれます:
酸化の半反応と還元の半反応についての骨格となる反応式を書きます。
HとOを除くすべての元素について、それぞれの半反応のバランスを取ります。
H₂Oを加えることにより、Oについてそれぞれの半反応のバランスを取ります。
H⁺を加えることにより、Hについてそれぞれの半反応のバランスを取ります。
電子を加えることにより、電荷についてそれぞれの半反応のバランスを取ります。
必要に応じて、一方の半反応または両方の半反応に数字を掛けて、一方で消費される電子の数が他方で生成される電子の数と等しくなるようにします。
2つの半反応を足し合わせて、単純化します。
反応が塩基性媒体中で行われる場合は、ステップ7で得られた式に OH⁻イオンを加えて(反応式の両側に等しい数で加えて)H⁺イオンを中和し、単純化します。
以下の例題では、水中の酸化-還元反応の反応式のバランスを取る際に、この方法を適用することを示します。
例題17.1 酸性溶液中の酸化-還元反応の反応式のバランスを取る
固体銅と硝酸が水溶性の銅(II)イオンと一酸化窒素気体を生成する反応を表すバランスの取れた反応式を書いてください。
解法
半反応法のステップに従って:
- 酸化の半反応と還元の半反応についての骨格となる反応式を書きます。
\[ {\rm 酸化: Cu\ (s) ⟶ Cu^{2+}\ (aq)}\\ {\rm 還元: HNO_3\ (aq) ⟶ NO\ (g)}\\ \]
- HとOを除くすべての元素について、それぞれの半反応のバランスを取ります。
\[ {\rm 酸化: Cu\ (s) ⟶ Cu^{2+}\ (aq)}\\ {\rm 還元: HNO_3\ (aq) ⟶ NO\ (g)}\\ \]
- H₂Oを加えることにより、Oについてそれぞれの半反応のバランスを取ります。
\[ {\rm 酸化: Cu\ (s) ⟶ Cu^{2+}\ (aq)}\\ {\rm 還元: HNO_3\ (aq) ⟶ NO\ (g)+ 2H_2 O\ (l)}\\ \]
- H⁺を加えることにより、Hについてそれぞれの半反応のバランスを取ります。
\[ {\rm 酸化: Cu\ (s) ⟶ Cu^{2+}\ (aq)}\\ {\rm 還元: 3H^+\ (aq) + HNO_3\ (aq) ⟶ NO\ (g) + 2H_2 O\ (l)}\\ \]
- 電子を加えることにより、電荷についてそれぞれの半反応のバランスを取ります。
\[ {\rm 酸化: Cu\ (s) ⟶ Cu^{2+}\ (aq)+ 2e^−}\\ {\rm 還元: 3e^− + 3H^+\ (aq) + HNO_3\ (aq) ⟶ NO\ (g) + 2H_2 O\ (l)}\\ \]
- 必要に応じて、一方の半反応または両方の半反応に数字を掛けて、一方で消費される電子の数が他方で生成される電子の数と等しくなるようにします。
\[ {\rm 酸化 (×3): 3Cu\ (s) ⟶ 3Cu^{2+}\ (aq) + 6e^−}\\ {\rm 還元 (×2): 6e^− + 6H^+\ (aq) + 2HNO_3\ (aq) ⟶ 2NO\ (g) + 4H_2 O\ (l)}\\ \]
- 2つの半反応を足し合わせて、単純化します。
\[ {\rm 3Cu\ (s) + 6e^− + 6H^+\ (aq) + 2HNO_3\ (aq) ⟶ 3Cu^{2+}\ (aq) + 6e^− + 2NO\ (g) + 4H_2 O\ (l)}\\ {\rm 3Cu\ (s) + 6H^+\ (aq) + 2HNO_3\ (aq) ⟶ 3Cu^{2+}\ (aq) + 2NO\ (g) + 4H_2 O\ (l)}\\ \]
- 反応が塩基性媒体中で行われる場合は、ステップ7で得られた式に OH⁻イオンを加えて(反応式の両側に等しい数で加えて)H⁺イオンを中和し、単純化します。
溶液が酸性であることが規定されているので、このステップは必要ありません。
酸性溶液中での反応についてのバランスの取れた反応式は以下のようになります。
\[ {\rm 3Cu\ (s) + 6H^+\ (aq) + 2HNO_3\ (aq) ⟶ 3Cu^{2+}\ (aq) + 2NO\ (g) + 4H_2 O\ (l)}\\ \]
学習内容の確認
上記の反応は、比較的希薄な硝酸を使用したときに起こります。もし濃縮された硝酸を使うと、一酸化窒素ではなく二酸化窒素が生成されます。この反応についてのバランスの取れた反応式を書いてください。
解答:Cu(s) + 2H⁺(aq) + 2HNO₃(aq) ⟶ Cu²⁺(aq) + 2NO₂(g) + 2H₂O(l)
例題17.2 塩基性溶液中の酸化-還元反応の反応式のバランスを取る
水溶性の過マンガン酸イオンMnO₄⁻と固体の水酸化クロム(III)Cr(OH)₃が、固体の酸化マンガン(IV)MnO₂と水溶性のクロム酸イオンCrO₄²⁻を生成する反応を表すバランスの取れた反応式を書いてください。この反応は塩基性溶液の中で起こります。
解法
半反応法のステップに従って:
- 酸化の半反応と還元の半反応についての骨格となる反応式を書きます。
\[ {\rm 酸化: Cr(OH)_3\ (s) ⟶ {CrO_4}^{2−}\ (aq)}\\ {\rm 還元: {MnO_4}^−\ (aq) ⟶ MnO_2\ (s)}\\ \]
- HとOを除くすべての元素について、それぞれの半反応のバランスを取ります。
\[ {\rm 酸化: Cr(OH)_3\ (s) ⟶ {CrO_4}^{2−}\ (aq)}\\ {\rm 還元: {MnO_4}^−\ (aq) ⟶ MnO_2\ (s)}\\ \]
- H₂Oを加えることにより、Oについてそれぞれの半反応のバランスを取ります。
\[ {\rm 酸化: H_2 O\ (l) + Cr(OH)_3\ (s) ⟶ {CrO_4}^{2−}\ (aq)}\\ {\rm 還元: {MnO_4}^−\ (aq) ⟶ MnO_2\ (s)+ 2H_2 O\ (l)}\\ \]
- H⁺を加えることにより、Hについてそれぞれの半反応のバランスを取ります。
\[ {\rm 酸化: H_2 O\ (l) + Cr(OH)_3\ (s) ⟶ {CrO_4}^{2−}\ (aq)+ 5H^+\ (aq)}\\ {\rm 還元: 4H^+\ (aq) + {MnO_4}^−\ (aq) ⟶ MnO_2\ (s) + 2H_2 O\ (l)}\\ \]
- 電子を加えることにより、電荷についてそれぞれの半反応のバランスを取ります。
\[ {\rm 酸化: H_2 O\ (l) + Cr(OH)_3\ (s) ⟶ {CrO_4}^{2−}\ (aq)+ 5H^+\ (aq)+ 3e^−}\\ {\rm 還元: 3e^− + 4H^+\ (aq) + {MnO_4}^−\ (aq) ⟶ MnO_2\ (s) + 2H_2 O\ (l)}\\ \]
必要に応じて、一方の半反応または両方の半反応に数字を掛けて、一方で消費される電子の数が他方で生成される電子の数と等しくなるようにします。
電子の数はすでにバランスが取れているので、このステップは必要ありません。2つの半反応を足し合わせて、単純化します。
\[ \begin{array}{ll} {\rm H_2 O\ (l) + Cr(OH)_3\ (s) + 3e^− + 4H^+\ (aq) + {MnO_4}^−\ (aq)}\\ {\rm \hspace{20pt} ⟶ {CrO_4}^{2−}\ (aq)+ 5H^+\ (aq)+ 3e^− + MnO_2\ (s) + 2H_2 O\ (l)}\\ つまり\\ {\rm Cr(OH)_3\ (s) + {MnO_4}^−\ (aq)}\\ {\rm \hspace{20pt} ⟶ {CrO_4}^{2−}\ (aq)+H^+\ (aq) + MnO_2\ (s) + H_2 O\ (l)}\\ \end{array} \]
- 反応が塩基性媒体中で行われる場合は、ステップ7で得られた式に OH⁻イオンを加えて(反応式の両側に等しい数で加えて)H⁺イオンを中和し、単純化します。
\[ \begin{array}{ll} {\rm OH^-\ (aq) + Cr(OH)_3\ (s) + {MnO_4}^−\ (aq)}\\ {\rm \hspace{20pt} ⟶ {CrO_4}^{2−}\ (aq)+H^+\ (aq) + OH^-\ (aq) + MnO_2\ (s) + H_2 O\ (l)}\\ つまり\\ {\rm OH^-\ (aq) + Cr(OH)_3\ (s) + {MnO_4}^−\ (aq) ⟶ {CrO_4}^{2−}\ (aq)+ MnO_2\ (s) + 2H_2 O\ (l)}\\ \end{array} \]
学習内容の確認
水溶性の過マンガン酸イオンはまた、水溶性の臭化物イオンBr⁻を用いて還元することもできます。この反応の生成物は、固体の酸化マンガン(IV)と水溶性の臭素酸イオンBrO₃⁻です。塩基性媒体中で起こるこの反応についてのバランスの取れた反応式を書いてください。
解答:H₂O(l) + 2MnO₄⁻(aq) + Br⁻(aq) ⟶ 2MnO₂(s) + BrO₃⁻(aq) + 2OH⁻(aq)
17.2 ガルバニ電池
この節が終わるまでに、あなたは次のことができるようになります:
•ガルバニ電池の機能とその構成要素について記述する
•電池図式を使用して、ガルバニ電池の構成と構造を記号化する
自発的な化学変化を示すものとして、図17.2は硝酸銀の水溶液の中にコイル状の銅線を浸した結果を示しています。最初は無色だった溶液が次第に青くなるとともに、 最初は滑らかだった銅線が灰色の多孔質の固体に覆われるようになるという、 徐々にではあるものの印象的に目に映る変化が自発的に起きています。

図17.2 | 銅線と硝酸銀水溶液(左側)を接触させると(中央)、自発的に電子の移動が起こり、青色のCu²⁺(aq)と灰色のAg(s)が生成されます(右側)。
これらの観察は、(i)元素の銅が酸化されて銅(II)イオンCu²⁺(aq)が生成され、溶液に青色を与えること、(ii)銀(I)イオンが還元されて元素の銀が生成され、銅線の表面にフワフワした固体として析出すること、と一致します。このように、銅線から水溶性の銀イオンへの電子の直接的な移動は、ここで採用された条件下では自発的に起きます。この酸化-還元系の概要は、以下の反応式によって与えられます:
\[ {\rm 全体の反応: Cu\ (s) + 2Ag^+\ (aq) ⟶ Cu^{2+}\ (aq) + 2Ag\ (s)}\\ {\rm 酸化の半反応: Cu\ (s) ⟶ Cu^{2+}\ (aq) + 2e^−}\\ {\rm 還元の半反応: 2Ag^+\ (aq) + 2e^− ⟶ 2Ag\ (s)}\\ \]
ここにあるような酸化-還元系のすべての反応物と生成物を含むものの、反応物間の物理的な接触を防ぐような装置の構造を考えてみましょう。したがって、電子の直接的な移動は妨げられており、代わりに、分離された反応物に接触する外部回路を介して間接的に移動が行われます。このような装置は一般的に電気化学電池と呼ばれており、その内部で自発的な酸化-還元反応が起こるものはガルバニ電池(またはボルタ電池)と呼ばれています。
銅と銀(I)の自発的な反応に基づくガルバニ電池が図17.3に描かれています。この電池は2つの半電池で構成されており、それぞれが単一の反応物の酸化-還元共役対(「カップル」)を含んでいます。左側に示されている半電池は、固体の銅箔と硝酸銅水溶液の形でCu(0)/Cu(II)カップルを含んでいます。右側の半電池は、固体の銀箔と硝酸銀水溶液としてAg(I)/Ag(0)カップルを含んでいます。外部回路はそれぞれの半電池に対してその固体箔のところで接続されています。これは、Cu箔とAg箔がそれぞれ電極として機能することを意味します。定義により、電気化学電池のアノードは酸化が起こる電極(ここではCu箔)であり、カソードは還元が起こる電極(Ag箔)です。ガルバニ電池における酸化-還元反応は、それぞれの半電池の反応混合物とその電極との間の界面でのみ起こります。電荷のバランスを維持しながら反応物を分離しておくために、2つの半電池の溶液は、塩橋と呼ばれる不活性電解質溶液で満たされたチューブによって接続されています。この電池内での自発的な反応により、アノード半電池ではCu²⁺カチオンが生成され、カソード半電池ではAg⁺イオンが消費され、その結果、塩橋から不活性イオンが補償するように流れて電荷のバランスが維持されます。アノード半電池のCu²⁺濃度の増加は、塩橋からのNO₃⁻の流入によってバランスが取られ、カソード半電池へのNa⁺の流れがAg⁺濃度の減少を補っています。
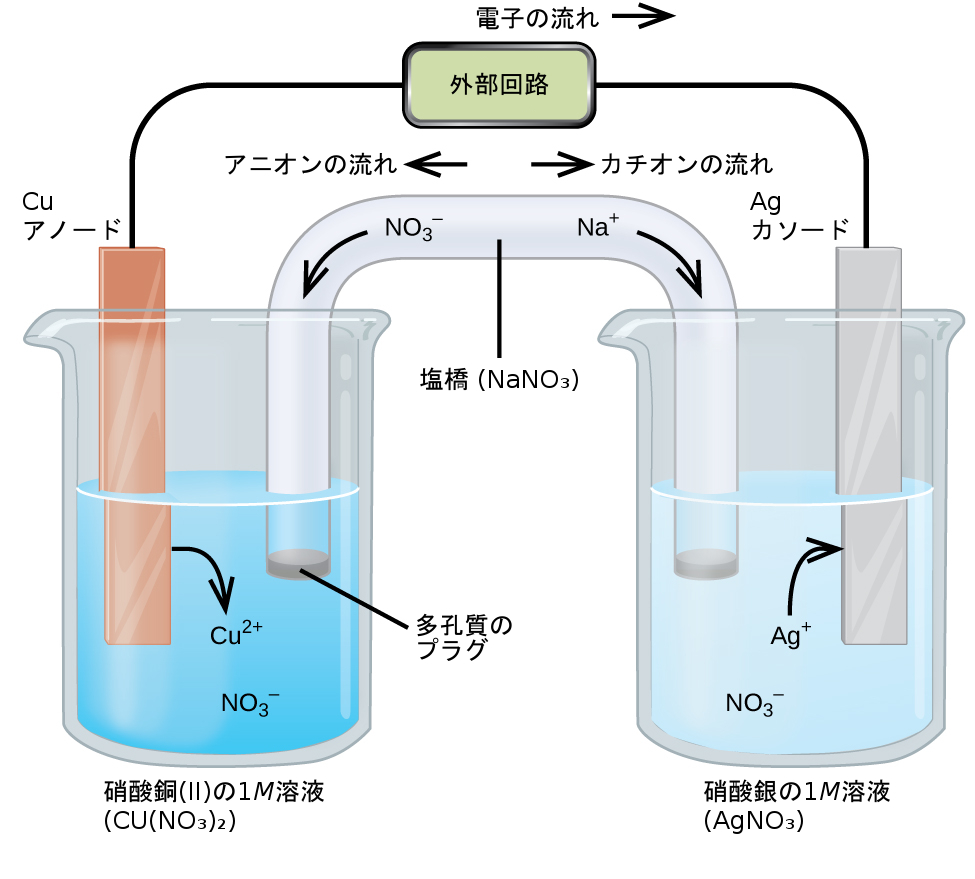
図17.3 | 銅と銀(I)イオン間の自発的な反応に基づくガルバニ電池。
電池図式
ガルバニ電池を表すために、省略された記号表現が一般的に使用されており、ガルバニ電池の構成と構造に関する重要な情報を提供してくれます。これらの記号表現は、電池図式または電池模式図と呼ばれ、それらはいくつかの指針に従って記述されます:
それぞれの半電池の関連する構成要素は、化学式または元素記号によって表されます
構成要素の相の間のすべての接触面は、垂直な平行線によって表されます。もし2つかそれ以上の構成要素が同じ相で存在する場合には、それらの化学式はカンマによって区切られます
慣例では、図式はアノードから始まり、左から右へと進み、電池内で出会う相と接触面を特定し、カソードで終了します
アノードからカソードまでを見たときの電池を言葉で記述することは、その図式を書く際の第一歩としてしばしば有用です。たとえば、図17.3に示されているガルバニ電池は、固体の銅のアノードが硝酸銅(II)の水溶液に浸されており、この硝酸銅(II)水溶液は塩橋を介して硝酸銀(I)の水溶液に接続されており、硝酸銀(I)水溶液の中には固体の銀のカソードが浸されています。上記の指針に従って、この文章を記号に変換すると、電池図式が得られます:
\[ {\rm Cu\ (s)} │ 1\ M\ {\rm Cu(NO_3)_2\ (aq)} ║ 1\ M\ {\rm AgNO_3\ (aq) │ Ag\ (s)}\\ \]
固体のマグネシウムと水溶性の鉄(III)イオンの間の自発的な反応に基づく別のガルバニ電池(図17.4参照)を考えてみましょう:
\[ {\rm 電池の全体の反応: Mg\ (s) + 2Fe^{3+}\ (aq) ⟶ Mg^{2+}\ (aq) + 2Fe^{2+}\ (aq)}\\ {\rm 酸化の半反応: Mg\ (s) ⟶ Mg^{2+}\ (aq) + 2e^−}\\ {\rm 還元の半反応: 2Fe^{3+}\ (aq) + 2e^− ⟶ 2Fe^{2+}\ (aq)}\\ \]
この電池では、固体のマグネシウムのアノードが塩化マグネシウムの水溶液に浸されており、塩化マグネシウム水溶液は塩橋を介して塩化鉄(III)と塩化鉄(II)の混合物を含む水溶液に接続されており、この水溶液の中に白金のカソードが浸されています。この電池の図式を書くと以下のようになります。
\[ {\rm Mg\ (s)} │ 0.1\ M\ {\rm MgCl_2\ (aq)} ║ 0.2\ M\ {\rm FeCl_3\ (aq)},\ 0.3\ M\ {\rm FeCl_2\ (aq) │ Pt\ (s)}\\ \]
このカソード半電池は、これまで検討してきた他の半電池とは異なり、電極が電池反応の反応物でも生成物でもない物質(Pt)で構成されていることに注目してください。これは、半電池の酸化-還元対のどちらのメンバーも電極として満足に機能しない場合に必要となります(電極は、電気伝導性があり、半電池の溶液とは別の相でなければなりません)。この場合、酸化-還元対の両方のメンバーが溶質種であり、したがって、Ptが、溶液中の酸化-還元種に電子を単に提供するか、または受け入れることのできる不活性電極として使用されます。この電池のMgアノードのように、酸化-還元対のメンバーから構成された電極は活性電極と呼ばれます。
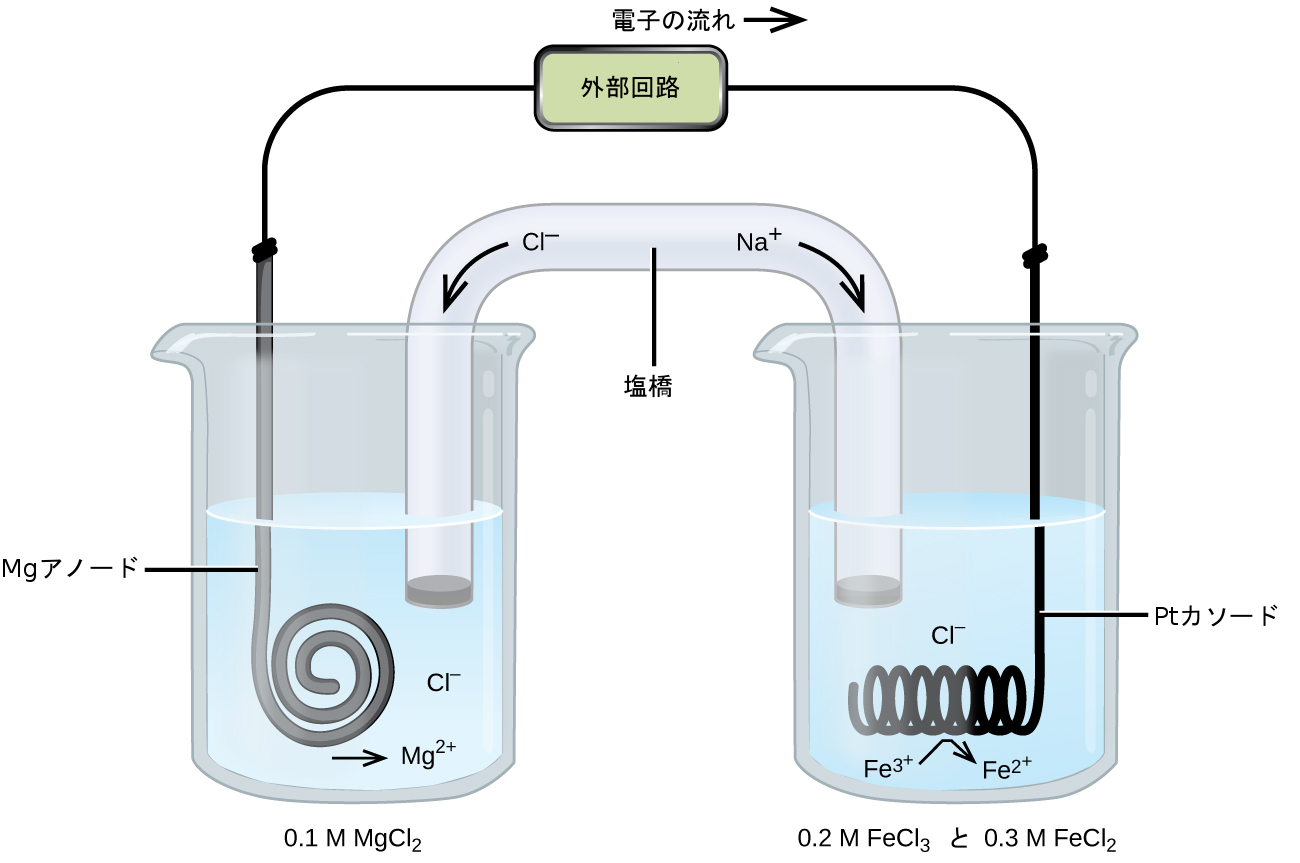
図17.4 | マグネシウムと鉄(III)イオン間の自発的な反応に基づくガルバニ電池。
例題17.3 ガルバニ電池の図式の書き方
あるガルバニ電池は、2つの半電池(1つはクロム線が1 MのCrCl₃溶液に浸されており、もう1つは銅線が1 MのCuCl₂に浸されています)を塩橋で接続することによって組み立てられています。クロム線がアノードとして機能すると仮定して、この電池の図式と、あわせてアノード半反応、カソード半反応、電池全体の反応の反応式を書いてください。
解法
クロム線がアノードと規定されているので、図式はそれから始まり、左から右へと進み、銅線のカソードで終わるまで他の電池の構成要素を記号化していきます:
\[ {\rm Cr\ (s)} │ 1 M {\rm CrCl_3\ (aq)} ║ 1 M {\rm CuCl_2\ (aq) │ Cu\ (s)}\\ \]
この電池の半反応は
\[ {\rm アノード (酸化): Cr\ (s) ⟶ Cr^{3+}\ (aq) + 3e^−}\\ {\rm カソード (還元): Cu^{2+}\ (aq) + 2e^− ⟶ Cu\ (s)}\\ \]
Crが失う電子の数と、Cu²⁺が得る電子の数が等しくなるように数字を掛けます。
\[ {\rm アノード (酸化): 2Cr\ (s) ⟶ 2Cr^{3+}\ (aq) + 6e^−}\\ {\rm カソード (還元): 3Cu^{2+}\ (aq) + 6e^− ⟶ 3Cu\ (s)}\\ \]
半反応式を足し合わせて単純化すると、電池の反応の反応式が得られます:
\[ {\rm 2Cr\ (s) + 3Cu^{2+}\ (aq) ⟶ 2Cr^{3+}\ (aq) + 3Cu\ (s)}\\ \]
学習内容の確認
溶質濃度と傍観イオンの種を省略して、電池全体の反応が以下のように示されているガルバニ電池の図式を書いてください。
\[ {\rm Sn^{4+}\ (aq) + Zn\ (s) ⟶ Sn^{2+}\ (aq) + Zn^{2+}\ (aq)}\\ \]
解答:Zn(s) │ Zn²⁺(aq) ║ Sn⁴⁺(aq), Sn²⁺(aq) │ Pt(s)
17.3 電極電位と電池電位
この節が終わるまでに、あなたは次のことができるようになります:
•電極電位と電池電位の定義を記述し、関連付ける
•電極電位を酸化剤と還元剤の相対的な強さの観点から解釈する
•電池電位を計算し、標準電極電位を用いて酸化-還元の自発性を予測する
17.2節で説明した水溶性の銀(I)イオンによる銅の自発的な酸化とは異なり、銅線を鉛(II)イオンの水溶液に浸しただけでは反応は起こりません。このように、Ag⁺(aq)とPb²⁺(aq)の2つの種は、銅に対する酸化-還元活性において明確な違いを示しています:銀イオンは自発的に銅を酸化しますが、鉛イオンは酸化しませんでした。電気化学電池では、この相対的な酸化-還元活性のことを、電位という簡単に測定できる性質によって定量化することができます。この性質は、電気的な用途で言及されるときにはより一般的に電圧と呼ばれています。これは電荷の移動に伴うエネルギーの尺度です。電位はボルト単位で測定されます。ボルトは、電荷1クーロンあたり1ジュールのエネルギー(V = J/C)として定義されています。
電気化学の目的で測定される場合、電位は特定のタイプの電荷移動プロセス、すなわち酸化-還元反応物間の電子の移動についての駆動力を反映しています。この文脈において電位の性質を考えると、単一の半電池や単一の電極の電位を測定できないことは明らかです。電子の「移動」には、供与体と受容体の両方(この場合はそれぞれ還元剤と酸化剤)が必要です。その代わり、半電池の電位は、他の半電池の電位との相対的な評価しかできません。測定できるのは、2つの半電池間の電位の差だけであり、これらの測定された電位は、電池電位E電池と呼ばれます。電池電位は以下のように定義されます。
\[ E_{電池} = E_{カソード} − E_{アノード}\\ \]
ここで、EカソードとEアノードは、添え字で指定されたように機能する2つの異なる半電池の電位です。他の熱力学的量と同じように、標準電池電位E°電池は、両方の半電池が標準状態の条件下(1 Mの濃度、1barの圧力、298 K)にあるときに測定された電池電位です:
\[ E°_{電池} = E°_{カソード} − E°_{アノード}\\ \]
半反応の電位データの収集と共有を簡単にするために、科学界では、電池電位の測定のための普遍的な基準として機能する特定の半電池を指定し、それに対して正確に0 Vの電位を割り当てました。この半電池が標準水素電極(SHE)であり、それは以下のような半反応を基にしています:
\[ {\rm 2H^+\ (aq) + 2e^− ⟶ H_2\ (g)}\\ \]
典型的なSHEは、不活性白金電極を正確に1Mの水溶性H⁺と、1barの圧力で泡立てるH₂気体の流れの中に浸したもので、すべてのものの温度は298Kに維持されています(図17.5参照)。
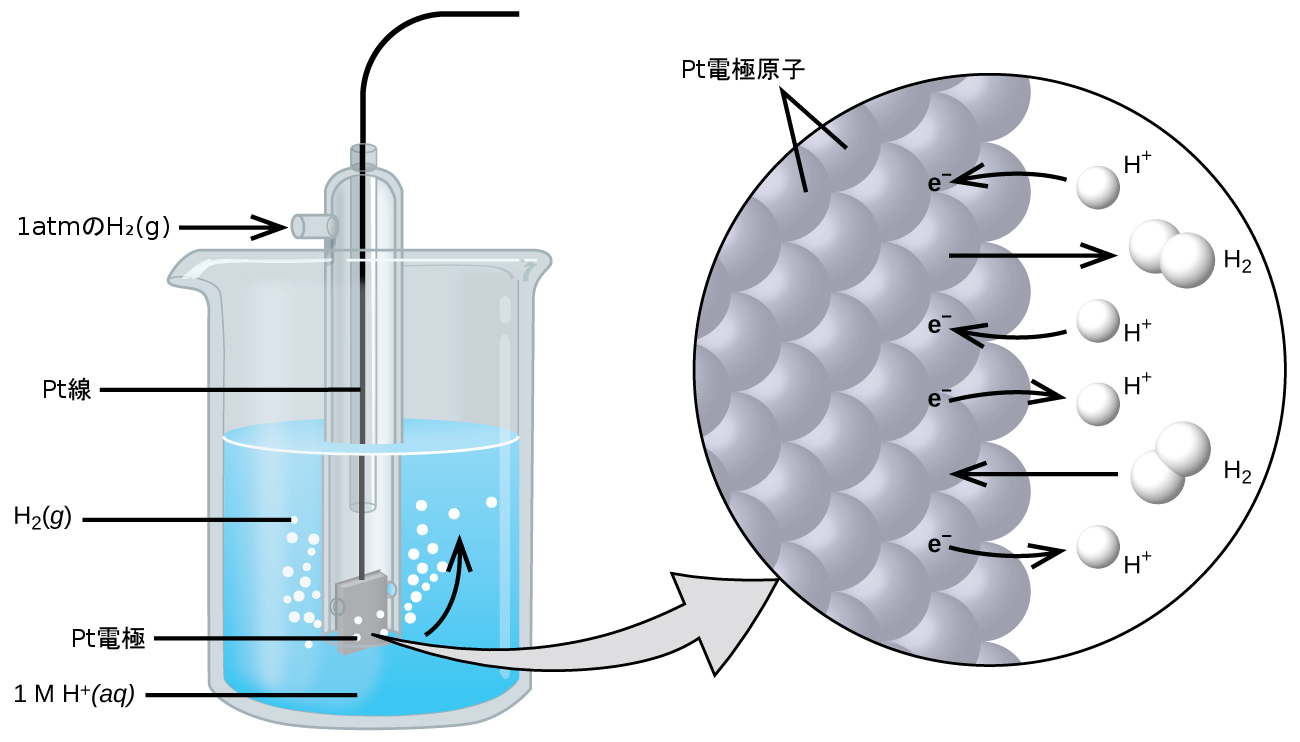
図17.5 | 標準水素電極(SHE)。
SHEの割り当てられた電位によって、単一の半電池について簡単に測定される電位を定義することができます。半電池Xの電極電位(Eₓ)は、Xがカソードとして作用し、SHEがアノードとして作用するように構成された電池について測定された電位として定義されます:
\[ E_{電池} = E_{\rm X} − E_{\rm SHE}\\ E_{\rm SHE} = 0 V\ (定義)\\ E_{電池} = E_{\rm X}\\ \]
半電池Xが標準状態の条件下にあるとき、その電位は標準電極電位 E°ₓです。電池電位の定義では、半電池がカソードとして機能することが必要なので、これらの電位は標準還元電位と呼ばれることもあります。
電極電位を測定するためのこのアプローチは図17.6に示されており、これは、標準状態の条件下で銅(II)/銅(0)半電池に接続されたSHEからなる電池を描いています。外部回路の電圧計によって、2つの半電池間の電位差を測定することができます。電池電位の定義では、Cu半電池がカソードとして指定されているため、それは電圧計の赤色の(正の)入力部に接続され、アノードに指定されたSHEは黒色の(負の)入力部に接続されています。これらの接続により、測定された電位の符号が、上記で議論されたさまざまな定義に基づく電気化学の符号規則と一致することが確実になります。0.337 Vの電池電位が測定されているので、以下のようになります。
\[ E °_{電池} = E °_{\rm Cu} = +0.337\ {\rm V}\\ \]
同様の方法で測定された他の半電池の E°の値の表を、電池電位の計算や酸化-還元過程の自発性を予測するための参照文献として利用することができます。
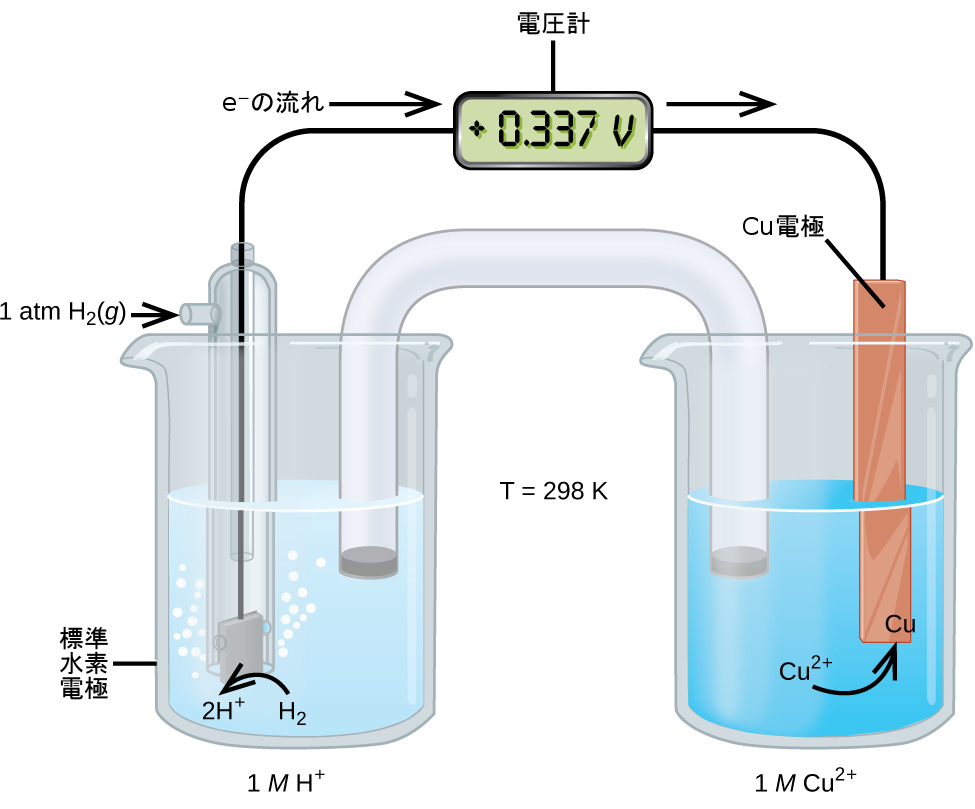
図17.6 | 半反応Cu²⁺(aq) + 2e⁻ ⟶ Cu(s)についての標準電極電位を実験的に測定できる電池。
表17.1は、選択された半反応の標準電極電位を数値順に列挙したものであり、付録Lにはより広範なアルファベット順のリストが与えられています。
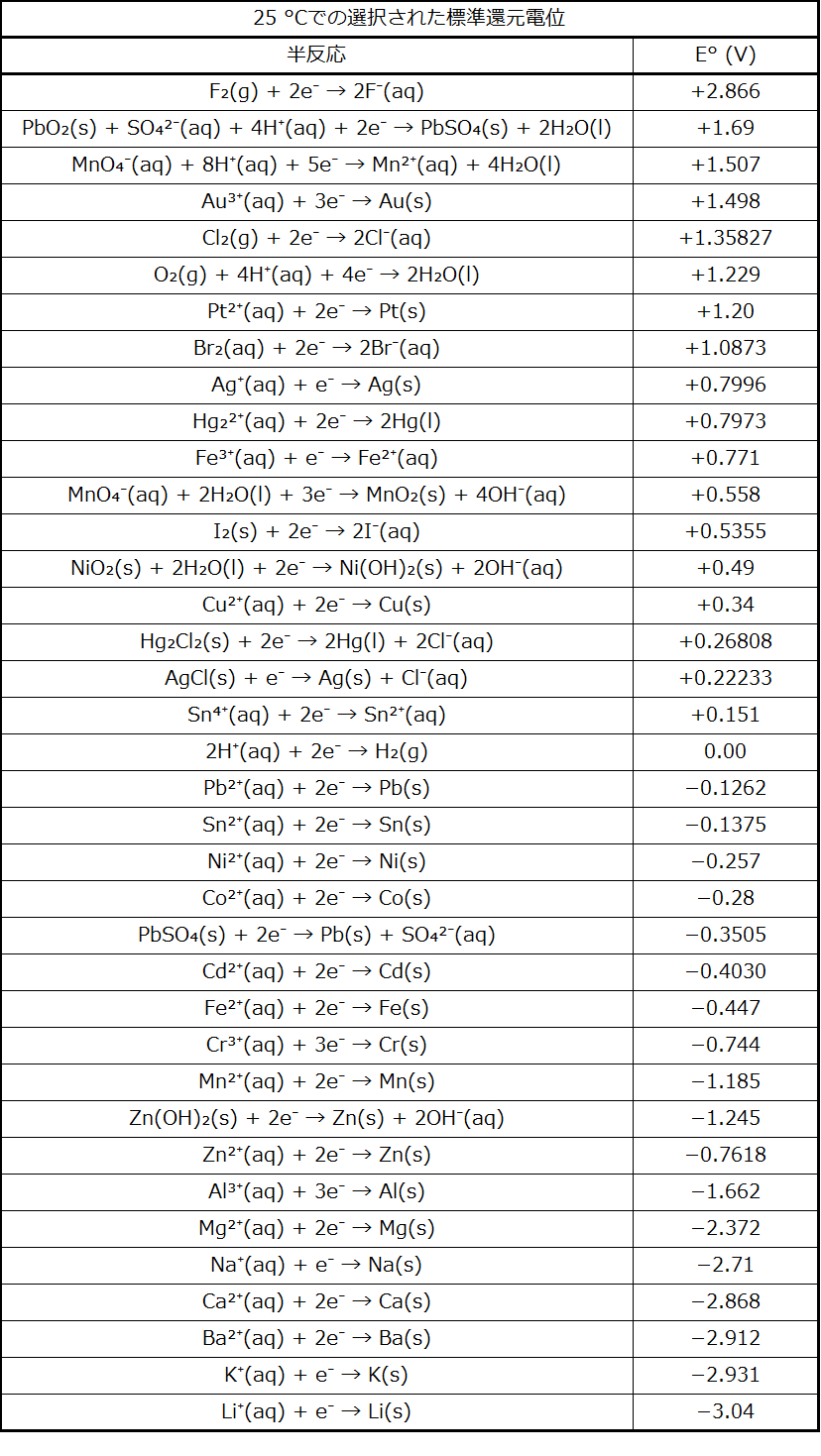
表17.1
例題17.4 標準電池電位を計算する
図17.3に示されたガルバニ電池の標準電位は何ですか?
解法
図17.3の電池はガルバニ電池であり、その自発的な電池反応には銅のアノードの酸化と銀のカソードでの銀(I)イオンの還元が含まれます:
\[ {\rm 電池反応: Cu\ (s) + 2Ag^+\ (aq) ⟶ Cu^{2+}\ (aq) + 2Ag\ (s)}\\ {\rm アノード半反応: Cu\ (s) ⟶ Cu^{2+}\ (aq) + 2e^−}\\ {\rm カソード半反応: 2Ag^+\ (aq) + 2e^− ⟶ 2Ag\ (s)}\\ \]
標準電池電位は以下のように計算されます。
\[ \begin{eqnarray} E °_{電池} &=& E °_{カソード} − E °_{アノード}\\ &=& E °_{\rm Ag} − E °_{\rm Cu}\\ &=& {\rm 0.7996\ V − 0.34\ V}\\ &=& {\rm +0.46\ V}\\ \end{eqnarray} \]
学習内容の確認
図17.3の銀カソードの半電池を鉛の半電池に置き換えた場合(Pb²⁺(aq) + 2e⁻ ⟶ Pb(s))に期待される標準電池電位は何ですか?
解答:−0. 47 V
電極電位と電池電位を解釈する
これまでに提示されてきた電池電位・電極電位の定義と、自発的な酸化-還元変化の観察とをよく考えてみると、重要な関係があることがわかります。前項では水溶性の銀(I)イオンによる銅の自発的な酸化について述べましたが、水溶性の鉛(II)イオンでは反応は観察されませんでした。例題17.4の計算結果は、自発的なプロセスは正の電池電位で記述されるのに対し、非自発的なプロセスは負の電池電位で記述されることを示しています。そして、標準条件下で水溶性のAg⁺イオンとPb²⁺イオンがCuを酸化する相対的な有効性(「強さ」)に関しては、より強い酸化剤がより大きな標準電極電位E°を示すものであることがわかります。慣例によって電極電位は還元過程についてのものであるため、E°の値が大きくなるということは、その種の還元の駆動力が大きくなるということ(したがって、他の種に対する酸化剤としての作用の有効性が大きくなるということ)に対応します。電極電位の負の値は、単にSHEに0 Vの値を割り当てた結果であり、半反応の反応物が水溶性の水素イオンよりも弱い酸化剤であることを示します。
この論理を表17.1の標準電極電位の数値順のリストに当てはめると、このリストも同様に、半反応の反応種の酸化力の強いほうから順番に、最も強い酸化剤(最も正のE°)から最も弱い酸化剤(最も負のE°)へと減少していっていることがわかります。標準状態の条件下での酸化-還元反応の自発性に関する予測は、単にそれらの表の項目の相対的な位置を比較するだけで簡単に行うことができます。定義により、E°電池は、E°カソード > E°アノードのときに正であり、したがって、酸化剤の項目が還元剤の項目よりも上にあるようなすべての酸化-還元反応は、自発的であると予測されます。
例題17.4の2つの酸化-還元反応をもう一度考えてみると、この事実を裏付けることができます。銀(I)/銀(0)半反応の項目は銅(II)/銅(0)半反応の項目の上にあるので、Ag⁺によるCuの酸化は自発的であると予測されます(E°カソード > E°アノード、したがってE°電池 > 0)。逆に、鉛(II)/鉛(0)の半電池の項目は銅(II)/銅(0)の項目より下にあり、Pb²⁺によるCuの酸化は非自発的です(E°カソード < E°アノード、したがってE°電池 < 0)。
熱力学の章を思い出すと、可逆過程の順反応と逆反応の自発性は相互に関係していることがわかります:ある過程が一方向で自発的であれば、逆方向では非自発的です。酸化-還元反応の自発性の指標として、電池反応の電位は、その算術符号において結果を表すような関係を示します。鉛(II)イオンによる銅の自発的酸化は観察されません。
\[ {\rm Cu\ (s) + Pb^{2+}\ (aq) ⟶ Cu^{2+}\ (aq) + Pb\ (s) }\hspace{20pt} E °_{順} = −0.47\ {\rm V}\ (負、非自発的)\\ \]
したがって、逆反応である銅(II)イオンによる鉛の酸化は自発的に起こると予測されます:
\[ {\rm Pb\ (s) + Cu^{2+}\ (aq) ⟶ Pb^{2+}\ (aq) + Cu\ (s)} \hspace{20pt} E °_{逆} = +0.47\ {\rm V}\ (正、自発的)\\ \]
酸化-還元反応の方向を逆にすると、実質的にカソードとアノードの半反応の同一性が入れ替わることになるので、電池電位は、順方向の反応とは逆になった引き算の順序の電極電位から計算されることに注意してください。実際には、電圧計は、その赤色と黒色の入力部がそれぞれPb電極とCu電極に接続された状態で-0.47 Vの電位を報告するでしょう。もし入力部が入れ替わると、報告される電圧は+0.47 Vになるでしょう。
例題17.5 酸化-還元の自発性を予測する
水溶性の鉄(II)イオンは標準状態の条件下で元素のクロムを自発的に酸化すると予測されますか?半反応は表17.1にあるものと仮定してください。
解法
表に示された半反応を参照すると、問題の酸化-還元反応は以下の式で表されます:
\[ {\rm Cr\ (s) + Fe^{2+}\ (aq) ⟶ Cr^{3+}\ (aq) + Fe\ (s)}\\ \]
推定上の酸化剤であるFe²⁺の項目は、還元剤であるCrの項目の上に表示されているので、上記の簡便なアプローチに従うと自発的な反応であると予測されます。この反応の標準電池電位を計算することにより、この予測を裏付けると、
\[ \begin{eqnarray} E °_{電池} &=& E °_{カソード} − E °_{アノード}\\ &=& E °_{\rm Fe(II)} − E °_{\rm Cr}\\ &=& {\rm −0.447\ V − (−0.774\ V) = +0.297\ V}\\ \end{eqnarray} \]
標準電池電位が正の値であることは、このプロセスが標準状態の条件下で自発的であることを示しています。
学習内容の確認
表17.1のデータを使用して、標準状態の条件下でヨウ素分子による臭化物イオンの酸化の自発性を予測し、その反応の標準電池電位を計算することによって予測を裏付けてください。臭素分子によるヨウ化物イオンの酸化についても同じことを繰り返してください。
解答:
I₂(s) + 2Br⁻(aq) ⟶ 2I⁻(aq) + Br₂(l) E °電池 = −0.5518V (非自発的)
Br₂(s) + 2I⁻(aq) ⟶ 2Br⁻(aq) + I₂(l) E °電池 = +0.5518V (自発的)
17.4 電位、自由エネルギー、および平衡
この節が終わるまでに、あなたは次のことができるようになります:
•電位、自由エネルギー変化、平衡定数の間の関係を説明する
•電池電位、自由エネルギー変化、平衡の間の関係を伴う計算を行う
•ネルンストの式を使用して、非標準条件下での電池電位を決定する
この章では、これまでに電池電位と反応の自発性との間の関係性を説明し、反応の自由エネルギー変化とのつながりを示唆してきました(熱力学の章を参照)。酸化剤の強さの尺度としての電位という解釈が提示され、酸-塩基の強さの同様の尺度が平衡定数に反映されていることを思い起こさせました(酸-塩基平衡の章を参照)。この節では、電位と関連する熱力学的な性質ΔGおよびKとの関係の要約を提供します。
E°およびΔG°
前の章では、あるプロセスの標準自由エネルギー変化ΔG°は、ある系が実行することのできる最大の仕事として定義されました。標準状態の条件下でガルバニ電池内で行われる酸化-還元反応の場合、本質的にすべての仕事は、還元剤から酸化剤への電子の移動w電子に関連しています:
\[ ΔG° = w_{\rm max} = w_{電子}\\ \]
電子の移動に関連する仕事は、移動した電荷の総量(クーロン)と電池電位によって決定されます:
\[ ΔG° = w_{電子} = −nFE°_{電池}\\ ΔG° = −nFE°_{電池}\\ \]
ここで、nは移動する電子のモル数、Fはファラデー定数、E°電池は標準電池電位です。自由エネルギー変化と標準電池電位の間の関係は、これらの性質の両方について以前に議論した符号の規則と自発性の基準を裏付けてくれます:自発的な酸化-還元反応は、正の電位と負の自由エネルギーの変化を示します。
E°およびK
以前に導き出したΔG°とKの間の関係(熱力学の章を参照)と、ΔG°とE°電池を関連付ける上記の式を組み合わせると、以下のようになります:
\[ ΔG° = −RT \ln K = −nFE°_{電池}\\ E°_{電池}=\left(\frac{RT}{nF}\right) \ln K\\ \]
この式は、大きな(正の)標準電池電位を持つ酸化-還元反応は、完了に向かって大いに進行し、反応物の大部分が生成物に変換されたときに平衡に達することを示しています。E°、ΔG°、およびKの間の関係の概要が図17.7に示されており、反応の自発性とこれらの性質の値との相関の表が表17.2に示されています。
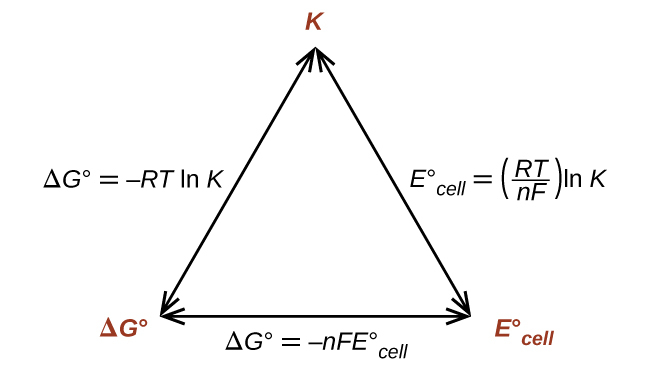
図17.7 | 3つの重要な熱力学的性質の間の関係を表した図。
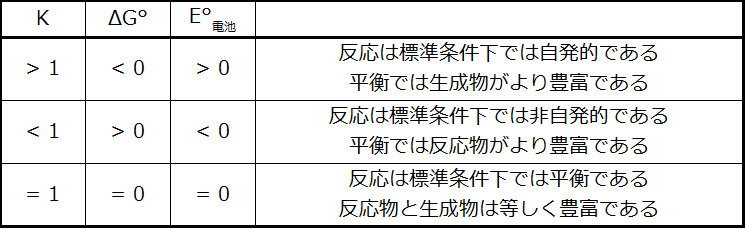
表17.2
例題17.6 平衡定数、標準電池電位、標準自由エネルギー変化
付録Lのデータを使用して、25 °Cでの以下の反応について標準電池電位、標準自由エネルギー変化、および平衡定数を計算してください。順方向の反応の自発性と、平衡混合物における反応物と生成物の組成についてコメントしてください。
\[ {\rm 2Ag^+\ (aq) + Fe\ (s) ⇌ 2Ag\ (s) + Fe^{2+}\ (aq)}\\ \]
解法
この反応は酸化-還元反応を伴うため、付録Lのデータを用いて標準電池電位を算出することができます。
\[ アノード (酸化): {\rm Fe\ (s) ⟶ Fe^{2+}\ (aq) + 2e^−} \hspace{20pt} E°_{\rm Fe^{2+} /Fe} = {\rm −0.447\ V}\\ カソード (還元): {\rm 2 × (Ag^+\ (aq) + e^− ⟶ Ag\ (s))} \hspace{20pt} E°_{\rm Ag^+ /Ag} = {\rm 0.7996\ V}\\ E °_{電池} = E °_{カソード} − E °_{アノード} = E°_{\rm Ag^+ /Ag} − E°_{\rm Fe^{2+} /Fe} = {\rm +1.247\ V}\\ \]
n = 2 とすると、平衡定数は以下のようになります。
\[ \begin{eqnarray} E °_{電池} &=&\frac{\rm 0.0592\ V}{n}\log K\\ K &=& 10^{n × E °_{電池} / \rm 0.0592\ V}\\ K &=& 10^{\rm 2 × 1.247\ V/0.0592\ V}\\ K &=& 10^{42.128}\\ K &=& 1.3 × 10^{42}\\ \end{eqnarray} \]
そして、標準自由エネルギーは
\[ \begin{eqnarray} ΔG° &=& −nFE °_{電池}\\ ΔG° &=& −2× 96485\ \frac{\rm C}{\rm mol}× 1.247\ \frac{\rm J}{\rm C}= −240.6\ \frac{\rm kJ}{\rm mol}\\ \end{eqnarray} \]
この反応は、負の自由エネルギー変化と正の電池電位によって示されるように、自発的なものです。Kの値は非常に大きく、それは、この反応が完了近くまで進み、生成物がほとんどであるような平衡混合物が得られることを示しています。
学習内容の確認
室温での以下の反応についての標準自由エネルギー変化と平衡定数は何ですか?この反応は自発的なものですか?
\[ {\rm Sn\ (s) + 2Cu^{2+}\ (aq) ⇌ Sn^{2+}\ (aq) + 2Cu^+\ (aq)}\\ \]
解答:自発的、 n = 2、E°電池 = +0.291 V、ΔG° = −56.2 kJ/mol、K = 6.8 × 10⁹
非標準条件での電位:ネルンストの式
科学や社会が関心を持つ酸化-還元過程のほとんどは、標準状態の条件下で発生することがないため、非標準条件下での系の電位は注目に値する性質となります。本節ではすでに電位と自由エネルギー変化の間の関係性を確立しており、先に議論した自由エネルギー変化と反応混合物の組成との間の関係をこの目的のために利用することができます。
\[ ΔG = ΔG° + RT \ln Q\\ \]
反応商Qがこの式に現れ、自由エネルギー変化を反応混合物の組成に依存するようにしていることに注意してください。自由エネルギー変化と電池電位を関連付ける式を代入すると、ネルンストの式が得られます:
\[ −nFE_{電池} = −nFE °_{電池} + RT \ln Q\\ E_{電池} = E °_{電池} −\frac{RT}{nF}\ln Q\\ \]
この式は、酸化-還元系(ガルバニ電池など)の電位がどのように標準状態の値から変化するかを記述しており、具体的には、それが移動する電子の数n、温度T、およびQに反映された反応混合物の組成の関数であることを示しています。ほとんどの仕事に対して便利なネルンストの式の形式は、基本定数(RとF)の値と自然対数から底が10の対数へと変換する係数が含まれているものです:
\[ E_{電池} = E °_{電池} −\frac{\rm 0.0592\ V}{n}\log Q\\ \]
例題17.7 非標準条件下での酸化-還元の自発性を予測する
ネルンストの式を用いて、以下に示される酸化-還元反応の自発性を予測してください。
\[ {\rm Co\ (s) + Fe^{2+}\ (aq,\ } 1.94\ M) ⟶ {\rm Co^{2+}\ (aq,\ } 0.15\ M) + {\rm Fe\ (s)}\\ \]
解法
付録Lと問題文から情報を集めると
\[ アノード (酸化): {\rm Co\ (s) ⟶ Co^{2+}\ (aq) + 2e^−} \hspace{20pt} E°_{\rm Co^{2+} /Co} = {\rm −0.28\ V}\\ カソード (還元): {\rm Fe^{2+}\ (aq) + 2e^− ⟶ Fe\ (s)} \hspace{20pt} E°_{\rm Fe^{2+} /Fe} = {\rm −0.447\ V}\\ E °_{電池} = E °_{カソード} − E °_{アノード} = {\rm −0.447\ V − (−0.28\ V) = −0.17\ V}\\ \]
標準電池電位の負の値は、このプロセスが標準条件の下で自発的ではないことを示していることに注意してください。非標準条件についてのネルンストの式の項に代入すると、以下が得られます:
\[ Q =\frac{\rm [Co^{2+}]}{\rm [Fe^{2+}]}=\frac{0.15\ M}{1.94\ M}= 0.077\\ \begin{eqnarray} E_{電池} &=& E °_{電池} −\frac{\rm 0.0592\ V}{n}\log Q\\ E_{電池} &=& {\rm −0.17\ V −\frac{0.0592\ V}{2}\log 0.077}\\ E_{電池} &=& {\rm −0.17\ V + 0.033\ V = −0.14\ V}\\ \end{eqnarray} \]
指定された条件下では、電池電位は(わずかに)負のままなので、反応は非自発的なままです。
学習内容の確認
以下の電池図式について、n と Q の値を特定し、電池電位 E電池を計算してください。
\[ {\rm Al\ (s) │ Al^{3+}\ (aq,\ }0.15\ M) ║ {\rm Cu^{2+}\ (aq,\ }0.025\ M) │ {\rm Cu\ (s)}\\ \]
解答: n = 6、Q = 1440、E電池 = +1.97 V、自発的
濃淡電池は、2つのほぼ同じ半電池を接続することによって構築されます。それぞれの半電池は、同じ半反応に基づき、同じ電極を使用しており、1つの酸化-還元種の濃度だけが異なるものです。したがって、濃淡電池の電位は、選択した酸化-還元種の濃度の違いによってのみ決定されます。以下の例題は、濃淡電池を含む計算においてネルンストの式を使用することを説明しています。
例題17.8 濃淡電池
以下によって記述される濃淡電池の電池電位は何ですか?
\[ {\rm Zn\ (s) │ Zn^{2+}\ (aq,\ }0.10\ M) ║ {\rm Zn^{2+}\ (aq,\ }0.50\ M) │ {\rm Zn\ (s)}\\ \]
解法
与えられた情報から:
\[ アノード: {\rm Zn\ (s) ⟶ Zn^{2+}\ (aq,\ }0.10\ M) + {\rm 2e^−} \hspace{20pt} E °_{アノード} = {\rm −0.7618\ V}\\ カソード: {\rm Zn^{2+}\ (aq,\ }0.50\ M) + {\rm 2e^− ⟶ Zn\ (s)} \hspace{20pt} E °_{カソード} = {\rm −0.7618\ V}\\ 全体: {\rm Zn^{2+}\ (aq,\ }0.50\ M) ⟶ {\rm Zn^{2+}\ (aq,\ }0.10\ M) \hspace{20pt} E °_{電池} = {\rm 0.000\ V}\\ \]
ネルンストの式に代入すると
\[ E_{電池} = {\rm 0.000\ V −\frac{0.0592\ V}{2} \log \frac{0.10}{0.50}= +0.021\ V}\\ \]
電池電位が正の値であることは、電池全体の反応(上記参照)が自発的であることを示しています。この自発的反応は、カソードの亜鉛イオン濃度が低下し(元素の亜鉛に還元されます)、アノードの亜鉛イオン濃度が上昇する(亜鉛アノードの酸化により生成されます)ような反応です。カソードでは亜鉛(II)イオン濃度が高く、亜鉛を還元するためのより大きな駆動力はカソードに存在します(Eカソード > Eアノード)。
学習内容の確認
上記の濃淡電池を、電池反応が平衡に達するまで作動させました。現在の電池について、それぞれの半電池の電池電位と亜鉛(II)の濃度は何ですか?
解答:E電池 = 0.000 V、[Zn²⁺]カソード = [Zn²⁺]アノード = 0.30 M
17.5 電池と燃料電池
この節が終わるまでに、あなたは次のことができるようになります:
•いくつかの一般的な電池(バッテリー)に関連する電気化学について記述する
•燃料電池の動作と電池の動作を区別する
過去2世紀にわたる電気化学の研究に関連した多くの技術製品がありますが、電池(バッテリー)ほどすぐに明らかなものはありません。電池とは、特別に設計され、特定の用途のための電力源としての意図された使用に最適な方法で構築されているガルバニ電池です。最初に成功した電池の中には、銅(II)イオンによる亜鉛の自発的な酸化に依拠するダニエル電池がありました(図17.8):
\[ {\rm Zn\ (s) + Cu^{2+}\ (aq)⟶Zn^{2+}\ (aq) + Cu\ (s)}\\ \]
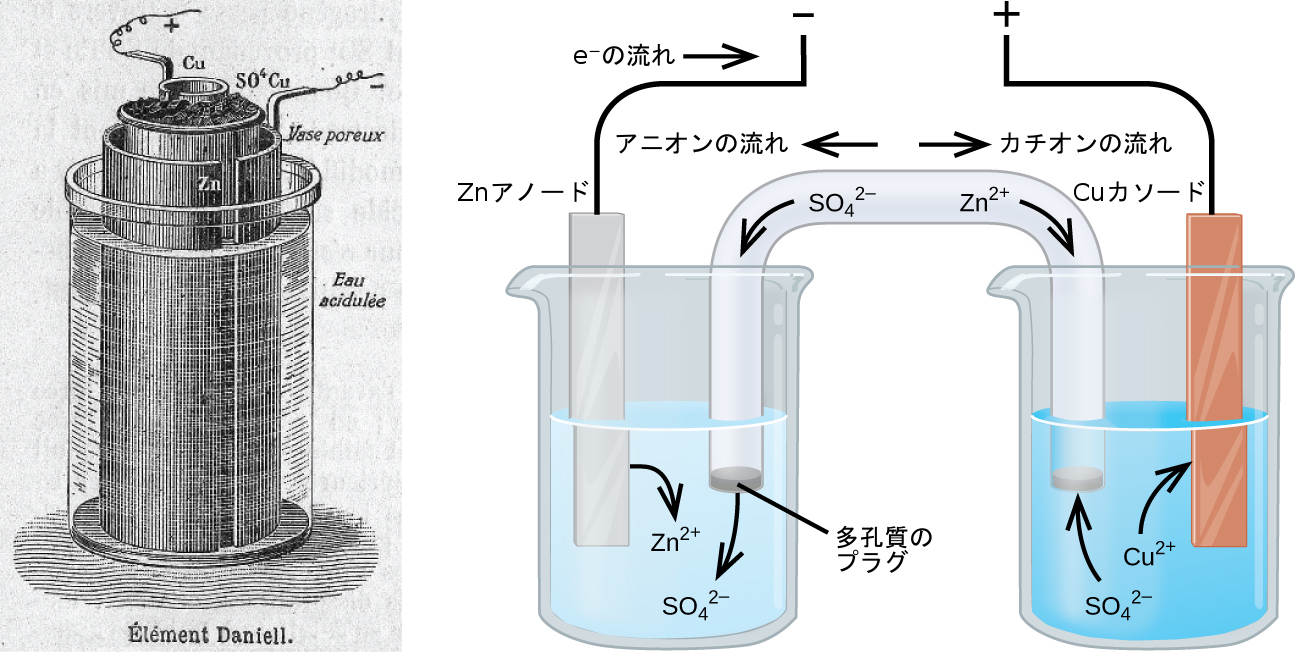
図17.8 | 1904年に出版されたジャーナルから引用されたダニエル電池のイラストレーション(左側)と、電池の電気化学を描いた簡略化されたイラストレーション(右側)。1904年の設計では、多孔質の陶器を使用して、半電池の内容物の1つを収容するとともに、もう1つの半電池への塩橋の役割を持たせています。
現代の電池は、腕時計に必要なささやかな電力を供給する小さなボタン電池から、自治体の電力網にバックアップエネルギーを供給するために使用される非常に大きな電池まで、さまざまな用途に対応するために多種多様な形態で存在しています。また、一度きりの使用の用途のために設計され、再充電することのできない電池(一次電池)もあれば、外部電源による再充電を可能とする、便利な可逆的電池反応を利用した電池(二次電池)もあります。この節では、ほとんどの消費者にとってなじみのあるいくつかの電池の基本的な電気化学的側面の概要を説明し、特定の用途において改善された性能を提供することのできる燃料電池と呼ばれる関連する電気化学装置を紹介します。
学習へのリンク
電池(バッテリー)についてより詳しく学ぶためには、このサイト(http://openstaxcollege.org/l/16batteries)を見てください。
一度きりの使用の電池
一般的な一次電池は乾電池であり、これは亜鉛の缶を容器とアノード(「-」端子)の両方として、黒鉛の棒をカソード(「+」端子)として使用します。亜鉛の缶は、酸化マンガン(IV)、塩化亜鉛(II)、塩化アンモニウム、水を含む電解質ペーストで満たされています。黒鉛の棒を電解質ペーストに浸すと電池が完成します。自発的な電池反応は亜鉛の酸化とマンガン(IV)の還元を伴います:
\[ {\rm アノード反応:Zn\ (s) ⟶ Zn^{2+}\ (aq) + 2e^−}\\ {\rm 還元反応:2MnO_2\ (s) + 2NH_4 Cl\ (aq) + 2 e^− ⟶ Mn_2 O_3\ (s) + 2NH_3\ (aq) + H_2 O\ (l)+ 2Cl^−}\\ \]
これを合わせると、電池反応が得られます:
\[ \begin{array}{ll} {\rm 電池反応:2MnO_2\ (s) + 2NH_4 Cl\ (aq) + Zn\ (s)}\\ \hspace{70pt} {\rm ⟶ Zn^{2+}\ (aq) + Mn_2 O_3\ (s) + 2NH_3\ (aq) + H_2 O\ (l) + 2Cl^−}\\ E_{電池} {\rm \sim 1.5 V}\\ \end{array} \]
乾電池の電圧(電池電位)は約1.5Vです。乾電池は、さまざまなサイズ(たとえば、D、C、AA、AAA)で利用可能です。すべてのサイズの乾電池は、同じ要素で構成されているため、同じ電圧を示しますが、より大きな電池は、より多くの量の酸化-還元反応物を含み、したがって、それに対応したより多くの量の電荷を移動させることができます。他のガルバニ電池と同様に、必要に応じて、乾電池を直列に接続して、より大きな電圧出力を持つ電池を得ることができます。
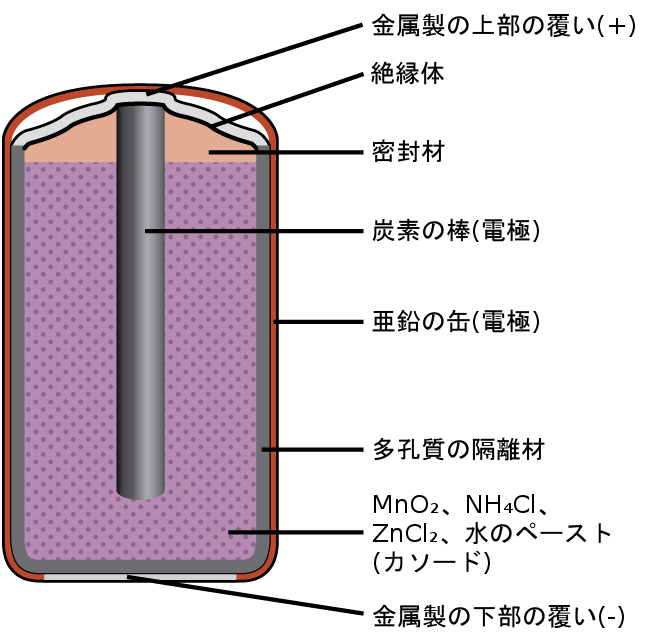
図17.9 | 典型的な乾電池を示す模式図。
学習へのリンク
亜鉛-炭素電池についてより詳しく学ぶためには、このサイト(http://openstaxcollege.org/l/16zinccarbon)を見てください。
アルカリ電池(図17.10)は、乾電池の性能を向上させるために1950年代に開発されたもので、同じ酸化-還元カップルを中心に設計されています。その名前が示すように、このタイプの電池はアルカリ性電解質、多くは水酸化カリウムを使用しています。その反応は以下の通りです。
\[ \begin{array}{ll} {\rm アノード: Zn\ (s) + 2OH^−\ (aq) ⟶ ZnO\ (s) + H_2 O\ (l) + 2e^−}\\ {\rm カソード:2MnO_2\ (s) + H_2 O\ (l) + 2e^− ⟶ Mn_2 O_3\ (s) + 2OH^−\ (aq)}\\ \hline {\rm 電池: Zn\ (s) + 2MnO_2\ (s) ⟶ ZnO\ (s) + Mn_2 O_3\ (s)} \hspace{20pt} E_{電池} = {\rm +1.43\ V}\\ \end{array} \]
アルカリ電池は、同じような大きさの亜鉛-炭素乾電池の約3~5倍のエネルギーを供給することができます。アルカリ電池は水酸化カリウムが漏れやすいので、機器を長期保管する場合はアルカリ電池を取り外しておく必要があります。アルカリ電池の中には再充電可能なものもありますが、ほとんどのものは再充電することはできません。充電式でないアルカリ電池を再充電しようとすると、しばしば電池が破裂して水酸化カリウムの電解液が漏れることがあります。
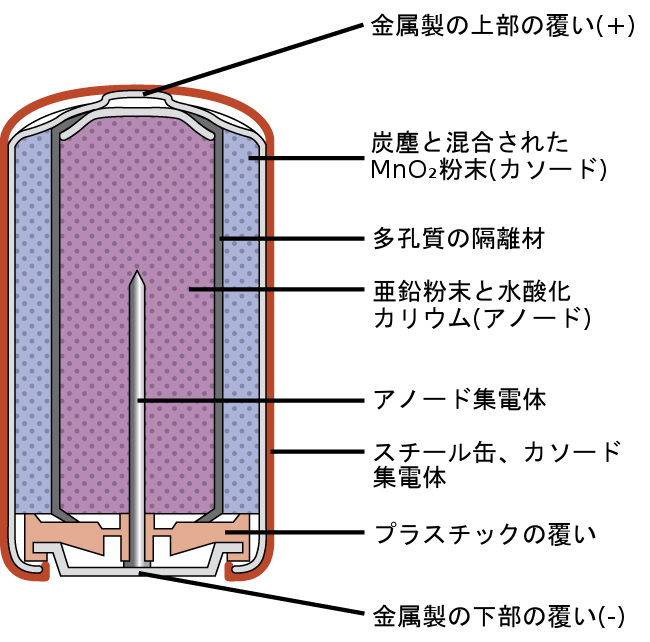
図17.10 | アルカリ電池は、亜鉛-炭素電池(乾電池)に代わる改良型電池として設計されました。
学習へのリンク
アルカリ電池についてより詳しく学ぶためには、このサイト(http://openstaxcollege.org/l/16alkaline)を見てください。
再充電可能な電池(二次電池)
ニッケル-カドミウム(NiCd)電池(図17.11)は、ニッケルめっきをしたカソード、カドミウムめっきをしたアノード、および水酸化カリウム電極で構成されています。隔離材によって短絡を防止した正極板と負極板を一緒に巻いてケースに入れます。これは「ゼリーロール」設計であり、NiCd電池は似たような大きさのアルカリ電池よりもはるかに大きな電流を流すことができます。その反応は、以下の通りです。
\[ \begin{array}{ll} {\rm アノード: Cd\ (s) + 2OH^−\ (aq) ⟶ Cd(OH)_2\ (s) + 2e^−}\\ {\rm カソード: NiO_2\ (s) + 2H_2 O\ (l) + 2e^− ⟶ Ni(OH)_2\ (s) + 2OH^−\ (aq)}\\ \hline {\rm 電池: Cd\ (s) + NiO_2\ (s) + 2H_2 O\ (l) ⟶ Cd(OH)_2\ (s) + Ni(OH)_2\ (s)} \hspace{20pt} E_{電池}\sim {\rm 1.2\ V}\\ \end{array} \]
適切に扱ったときには、NiCd電池は約1000回充電することができます。カドミウムは有毒な重金属であるため、NiCd電池は決して破裂させたり焼却したりしてはならず、関連する有毒廃棄物の指針に従って廃棄されるべきです。
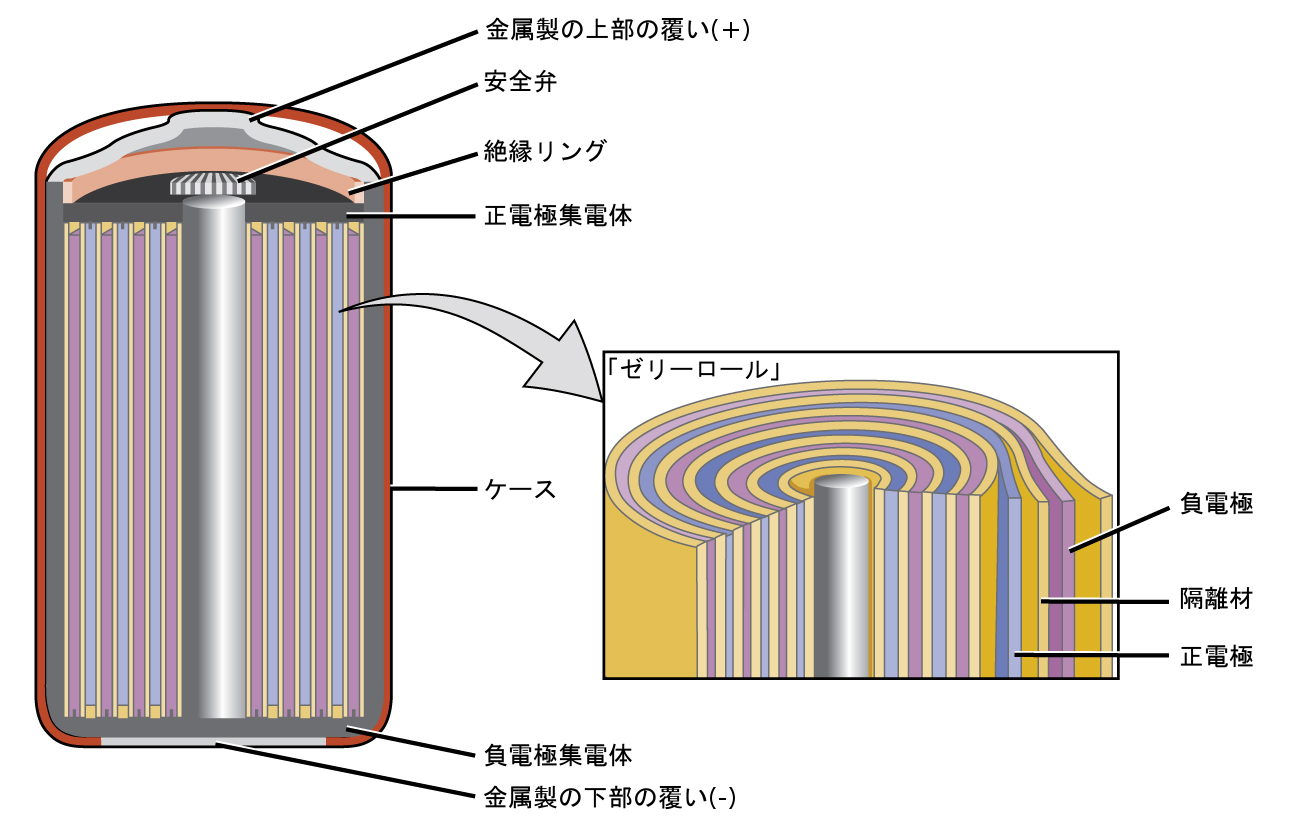
図17.11 | NiCd電池は、似たような大きさのアルカリ電池と比較して、電池が流すことのできる電流の量を大幅に増加させるような「ゼリーロール」設計を使用しています。
学習へのリンク
ニッケルカドミウム再充電可能電池についてのより詳しい情報は、このサイト(http://openstaxcollege.org/l/16NiCdrecharge)を見てください。
リチウムイオン電池(図17.12)は、最も普及している再充電可能電池の1つで、多くの携帯電子機器に使用されています。その反応は以下の通りです。
\[ \begin{array}{ll} {\rm アノード: LiCoO_2 ⇌ Li}_{1−x} {\rm CoO_2} + x {\rm Li^+} + x {\rm e^−}\\ カソード: x {\rm Li^+} + x {\rm e^−} + x {\rm C_6} ⇌ x {\rm LiC_6}\\ \hline 電池: {\rm LiCoO_2} + x {\rm C_6} ⇌ {\rm Li}_{1−x} {\rm CoO_2} + x {\rm LiC_6} \hspace{20pt} E_{電池}\sim {\rm 3.7\ V}\\ \end{array} \]
電池反応の化学量論が可変であるため、電池電圧にばらつきが生じますが、典型的な条件では、xは通常0.5以下、電池電圧は約3.7Vです。リチウム電池は、大量の電流を供給することができ、他の種類の同等の電池よりも軽量で、放電時にはほぼ一定の電圧が得られ、保存時には充電がゆっくりとしか失われないため、人気があります。
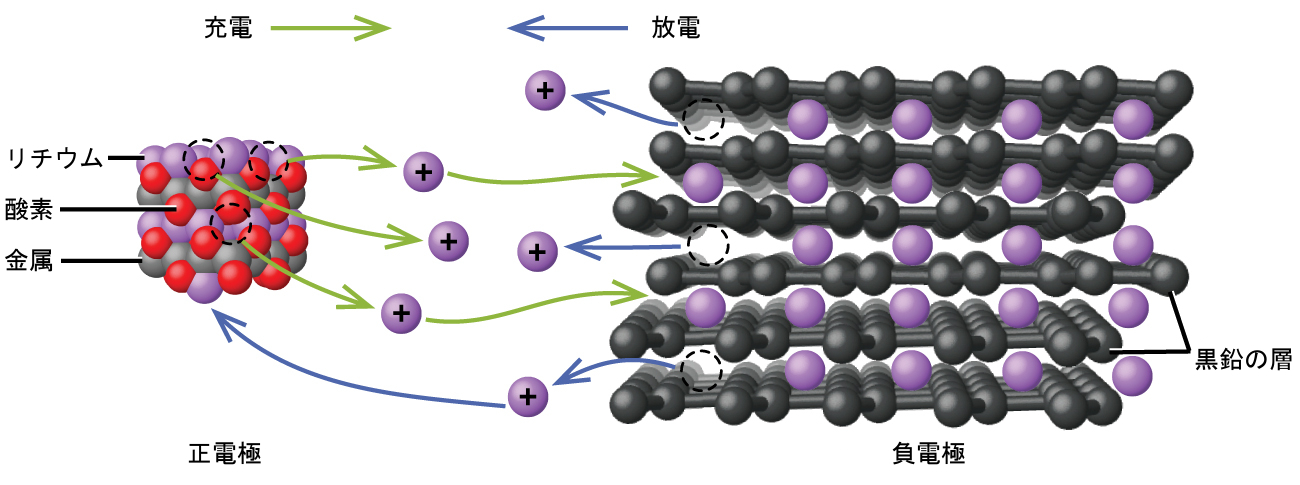
図17.12 | リチウムイオン電池では、リチウムイオンがアノードとカソードの間を移動することで電荷が流れます。
学習へのリンク
リチウムイオン電池についてのより詳しい情報は、このサイト(http://openstaxcollege.org/l/16lithiumion)を見てください。
鉛酸蓄電池(図17.13)は、自動車で一般的に使用されている二次電池の一種です。それは安価で、自動車の始動モーターに必要な大電流を流すことができます。鉛酸蓄電池の反応は以下の通りです。
\[ \begin{array}{ll} {\rm アノード: Pb\ (s) + {HSO_4}^−\ (aq) ⟶ PbSO_4\ (s) + H^+\ (aq) + 2e^−}\\ {\rm カソード: PbO_2\ (s) + {HSO_4}^−\ (aq) + 3H^+\ (aq) + 2e^− ⟶ PbSO_4\ (s) + 2H_2 O\ (l)}\\ \hline {\rm 電池: Pb\ (s) + PbO_2\ (s) + 2H_2 SO_4\ (aq) ⟶ 2PbSO_4\ (s) + 2H_2 O\ (l)} \hspace{20pt} E_{電池} \sim {\rm 2\ V}\\ \end{array} \]
それぞれの電池は2Vを生成するので、6つの電池を直列に接続すると12Vの自動車用バッテリーになります。鉛酸蓄電池は重く、苛性液体の電解液であるH₂SO₄(aq)を含んでいますが、電流密度が高いため、しばしばまだバッテリーとして選択されています。これらのバッテリーにはかなりの量の鉛が含まれているため、常に適切に廃棄しなければなりません。
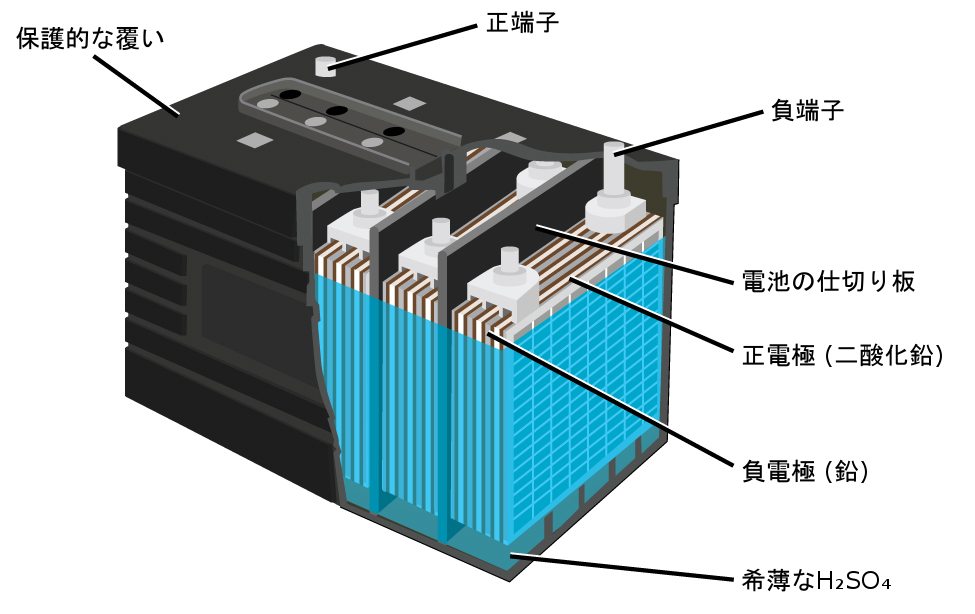
図17.13 | 自動車の鉛酸蓄電池は、6つの電池を直列に接続して12Vを生成するように構成されています。
学習へのリンク
鉛酸蓄電池についてのより詳しい情報は、このサイト(http://openstaxcollege.org/l/16leadacid)を見てください。
燃料電池
燃料電池は、従来の可燃性燃料(多くの場合、水素やメタン)を使用するガルバニ電池です。この燃料は、酸化剤と一緒に電池へ向けて連続的に供給されます。(燃料電池の代替的な名称として、フロー電池がありますが、あまり一般的ではありません。)電池内では、燃料と酸化剤は燃焼される時と同じ酸化-還元化学反応を起こしますが、触媒を介して電気化学的に起こるため、はるかに効率的です。たとえば、典型的な水素燃料電池では、2つの半電池反応を促進するために、白金系触媒を埋め込んだ黒鉛電極を使用しています:
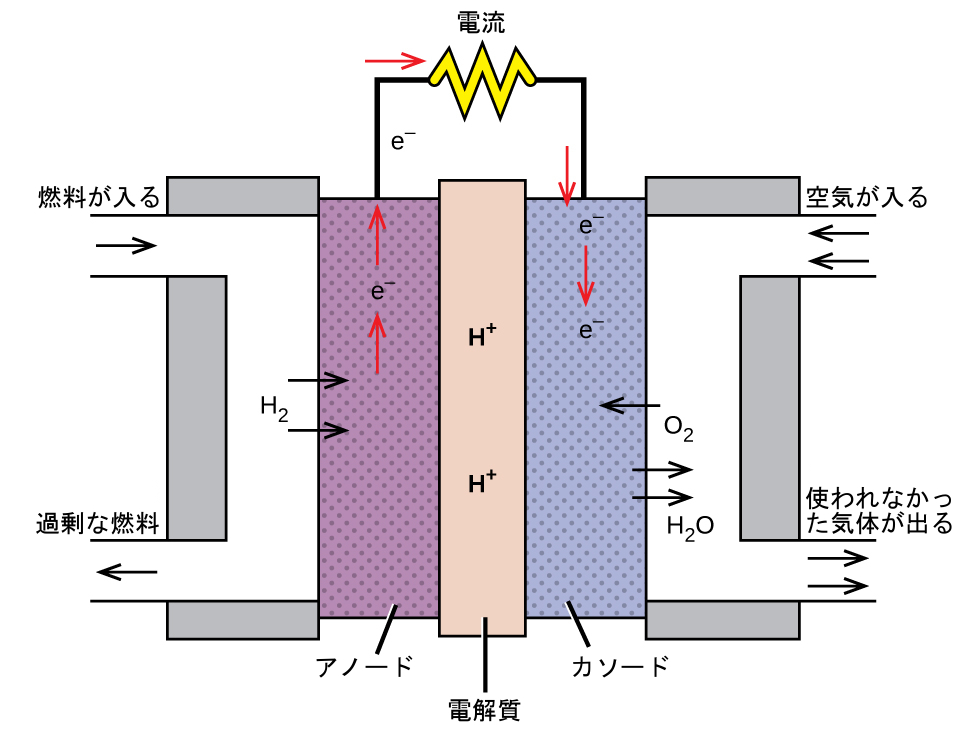
図17.14 | この水素燃料電池は、空気中の酸素と水素を反応させて水と電気を発生させています。
\[ \begin{array}{ll} {\rm アノード: 2H_2\ (g) ⟶ 4H^+\ (aq) + 4e^−}\\ {\rm カソード:O_2\ (g) + 4H^+\ (aq) + 4e^− ⟶ 2H_2 O\ (g)}\\ \hline {\rm 電池: 2H_2\ (g) + O_2\ (g) ⟶ 2H_2 O\ (g)} \hspace{20pt} E_{電池} \sim {\rm 1.2\ V}\\ \end{array} \]
このタイプの燃料電池は、一般的に約1.2Vの電圧を生成します。内燃機関と比較して、同じ酸化-還元反応を利用した燃料電池のエネルギー効率は、通常は、2倍以上になります(エンジンの場合は約20~25%、燃料電池の場合は約50~75%)。水素燃料電池は、長期宇宙ミッションで一般的に使用されており、個人用の乗り物のプロトタイプも開発されていますが、その技術はまだ比較的未熟です。
学習へのリンク
燃料電池についてより詳しく学ぶためには、このサイト(http://openstaxcollege.org/l/16fuelcells)をチェックしてください。
17.6 腐食
この節が終わるまでに、あなたは次のことができるようになります:
•腐食を定義する
•腐食を防止またはゆっくりにするために使用される方法のいくつかを列挙する
腐食は、自然に発生する電気化学的プロセスによる金属の劣化であると通常は定義されています。鉄の錆の形成、銀の変色、銅に発生する青緑色の緑青は、すべて腐食の例です。米国では、腐食の修復にかかる総費用は膨大なもので、年間で5000億ドルを超えると推定されています。
日常生活の中の化学
自由の女神像:変化する色
自由の女神像は、アメリカ人なら誰もが見覚えのある建造物です。自由の女神像は、その高さ、姿勢、そして独特の青緑の色合いで容易に特定できます(図17.15)。この像が最初にフランスから送られてきたとき、その外観は緑色ではありませんでした。それは、銅の「表皮」の色である茶色でした。では、自由の女神像はどのようにして色が変わったのでしょうか?外観の変化は腐食による直接的な結果です。自由の女神像の主成分である銅は、空気によってゆっくりと酸化されていきました。環境中における銅金属の酸化-還元反応は、いくつかの段階でもって起こります。銅金属は酸化されて赤色の酸化銅(I)(Cu₂O)になり、次に黒色の酸化銅(II)になります。
\[ {\rm 2Cu\ (s) +\frac{1}{2} O_2\ (g) ⟶ Cu_2 O\ (s)\ (赤色)}\\ {\rm Cu_2 O\ (s) +\frac{1}{2}O_2\ (g) ⟶ 2CuO\ (s)\ (黒色)}\\ \]
しばしば硫黄分を多く含む石炭は、前世紀初頭に大規模に燃焼されました。その結果として大気中に放出された三酸化硫黄、二酸化炭素、水は、どれもCuOと反応しました。
\[ {\rm 2CuO\ (s) + CO_2\ (g) + H_2 O\ (l) ⟶ Cu_2 CO_3 (OH)_2\ (s)\ (緑色)}\\ {\rm 3CuO\ (s) + 2CO_2\ (g) + H_2 O\ (l) ⟶ Cu_2 (CO_3 )_2 (OH)_2\ (s)\ (青色)}\\ {\rm 4CuO\ (s) + SO_3\ (g) + 3H_2 O\ (l) ⟶ Cu_4 SO_4 (OH)_6\ (s)\ (緑色)}\\ \]
これら3つの化合物が、自由の女神像(や、その他の屋外の銅の建造物)に見られる特徴的な青緑色の緑青の原因となっています。幸いなことに、緑青が形成されることで銅の表面に保護層が作り出され、その下にある銅のさらなる腐食を防いでくれます。この保護層の形成は不動態化と呼ばれる現象で、この教科書の別の章で詳しく議論されています。

図17.15 | (a)自由の女神像は銅の表皮で覆われており、もともとはこの絵画で示されているように茶色でした。(b)風雨にさらされた結果、今日見られるような青緑色の緑青が形成されました。
おそらく腐食の最も身近な例は、鉄に錆が発生することでしょう。鉄は酸素と水にさらされると錆びます。錆の形成には、図17.16に示されるように、鉄の表面にガルバニ電池が作り出されることが関係しています。関連する酸化-還元反応は次の反応式によって記述されます:
\[ アノード: {\rm Fe\ (s) ⟶ Fe^{2+}\ (aq) + 2e^−} \hspace{20pt} E°_{\rm Fe^{2+} /Fe} = {\rm −0.44\ V}\\ カソード: {\rm O_2\ (g) + 4H^+\ (aq) + 4e^− ⟶ 2H_2 O\ (l)} \hspace{20pt} E°_{\rm O_2 /H_2O} = {\rm +1.23\ V}\\ 全体: {\rm 2Fe\ (s) + O_2\ (g) + 4H^+\ (aq) ⟶ 2Fe^{2+}\ (aq) + 2H_2 O\ (l)} \hspace{20pt} E°_{電池} = {\rm +1.67\ V}\\ \]
湿った空気中で鉄(II)生成物をさらに反応させると、錆として知られる酸化鉄(III)水和物が生成されます:
\[ {\rm 4Fe^{2+}\ (aq) + O_2\ (g)} + (4 + 2x){\rm H_2 O\ (l) ⟶ 2Fe_2 O_3} ·x{\rm H_2 O\ (s) + 8H^+\ (aq)}\\ \]
この水和物の化学量論は、化合物の化学式中にxを用いることで示されているように、変化します。銅の緑青とは異なり、錆の形成は保護層を作り出さないため、錆が剥がれ落ちて新鮮な鉄が大気中に露出するにつれ、鉄の腐食が継続します。
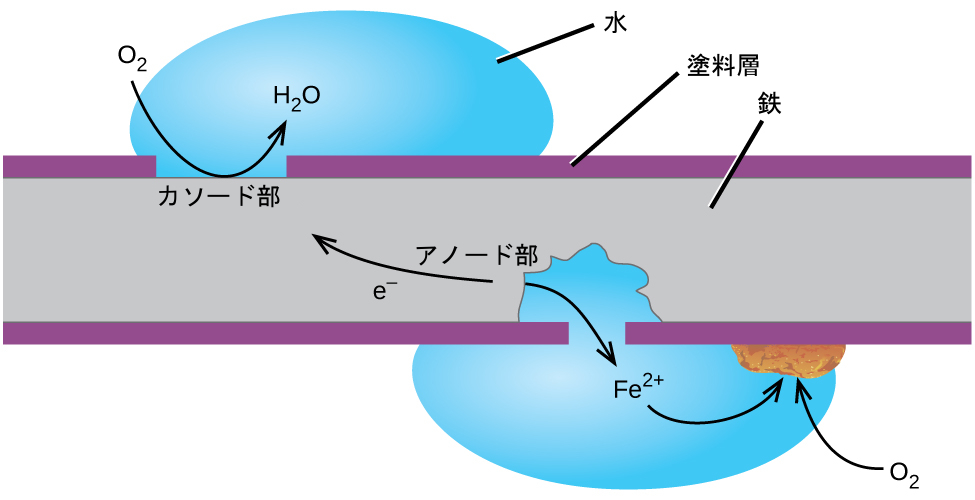
図17.16 | 腐食は、塗装された鉄やスチールの表面が、塗料を貫通するような傷によって環境にさらされたときに発生することがあります。その結果生じるガルバニ電池は、単純化された電池図式Fe(s) | Fe²⁺(aq) || O₂(aq), H₂O(l) | Fe(s)によって近似することができます。
鉄を腐食させないための1つの方法は、塗装をしておくことです。塗料の層があることで、錆の形成に必要な水や酸素が鉄と接触するのを防ぐことができます。塗料がそのまま残っている限り、鉄は腐食から守られています。
他の方法としては、鉄を他の金属と合金化するやり方があります。たとえば、ステンレス鋼は少量のクロムを含む鉄の合金です。クロムは表面近くに集まる傾向があり、そこで腐食し、鉄を保護する不動態化した酸化物層を形成します。
鉄やその他の金属は、亜鉛めっきによって腐食から保護されることもあります。亜鉛めっきは、保護する金属をより酸化しやすい金属(通常は亜鉛)の層で被覆するプロセスです。亜鉛層が無傷のままの状態であれば、下地の鉄に空気が接触するのを妨げ、腐食を防ぎます。亜鉛層が腐食または機械的摩耗によって破れた場合でも、カソード防食プロセス(次の段落で説明します)によって鉄を腐食から保護することができます。
金属を保護するもう1つの重要な方法は、それをガルバニ電池のカソードにすることです。これがカソード防食であり、鉄以外の金属にも適用することができます。たとえば、地下の鉄製貯蔵タンクやパイプの錆は、亜鉛やマグネシウムのようなより活性の高い金属に接続することによって防いだり、大幅に減らしたりすることができます(図17.17)。これはまた、湯沸かし器の金属部分の保護にも利用されています。より活性の高い(より還元電位が低い)金属は、犠牲陽極と呼ばれています。なぜなら、それらがアノードで腐食(酸化)すると使い果たされてしまうからです。保護されている金属は、空気中の酸素の還元のためのカソードとして機能するので、単に移動される電子を伝導する(反応するのではなく)役割を果たします。アノードを適切に監視し、定期的に交換することで、鉄製貯蔵タンクの耐用寿命を大幅に延ばすことができます。
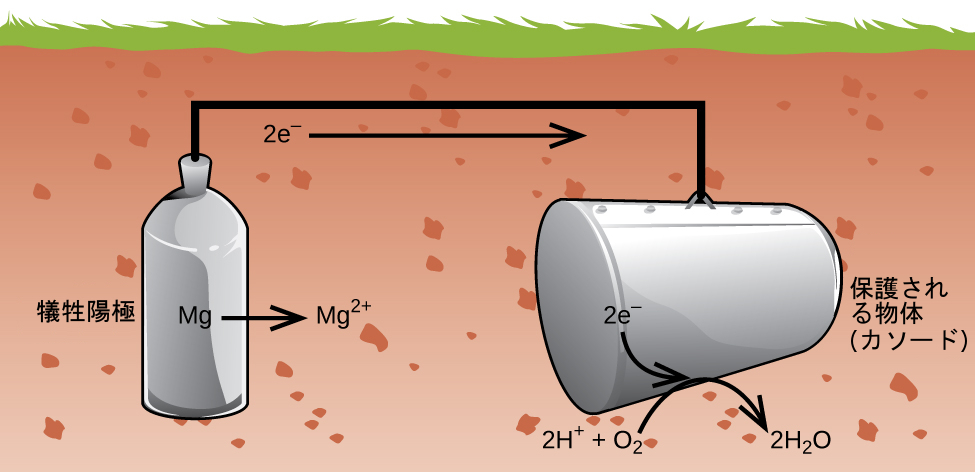
図17.17 | カソード防食は、地下貯蔵タンクの腐食を電気化学的に防止するための有用な方法です。
17.7 電気分解
この節が終わるまでに、あなたは次のことができるようになります:
•電気分解のプロセスを記述する
•電解電池の動作とガルバニ電池の動作を比較する
•電気分解過程についての化学量論的計算を行う
この章では、これまで自発的に酸化-還元反応が起こる電気化学電池(ガルバニ電池)を議論の話題にしてきました。これらの電池では、酸化-還元反応によって生成された電子が外部回路を介して伝達されることで、酸化-還元系によって周囲に対して電気的な仕事が行われています。本章のこの最後の節では、外部回路が十分な電圧を印加することによって酸化-還元系に作用し、その電圧がなければ非自発的であるような反応を駆動するという代替的なシナリオを取り上げます。これは、電気分解として知られるプロセスです。電気分解のよく知られた例としては、バッテリーの充電があります。これは、外部電源を使用して、自発的な(放電)電池反応を逆方向に駆動し、半電池の組成とバッテリーの電圧をある程度回復させます。おそらくもっと知られていないものとしては、金属鉱石の精製、汎用化学品の製造、さまざまな製品(宝石、器具、自動車部品など)への金属コーティングの電気めっきに電気分解を使用することです。電気分解の本質的な概念を説明するために、いくつかの特定のプロセスを検討していきます。
溶融した塩化ナトリウムの電気分解
金属ナトリウムNa、および塩素気体Cl₂は多くの用途に使用されており、それらの工業的な生産は、溶融した塩化ナトリウムNaCl(l)の大規模な電気分解に依拠しています。工業プロセスでは通常、図17.18に示される簡略化された図のようなダウンズセルを使用します。このプロセスに関連する反応は以下の通りです:
\[ \begin{array}{ll} {\rm アノード: 2Cl^−\ (l) ⟶ Cl_2\ (g) + 2e^−}\\ {\rm カソード: Na^+\ (l) + e^− ⟶ Na\ (l)}\\ \hline {\rm 電池: 2Na^+\ (l) + 2Cl^−\ (l) ⟶ 2Na\ (l) + Cl_2\ (g)}\\ \end{array} \]
上記のプロセスの電池電位は負であり、書かれているような反応(液体NaClの分解)は自発的ではないことを示しています。この反応を強制的に進めるためには、負の電池電位よりも大きな正の電位を電池に印加しなければなりません。
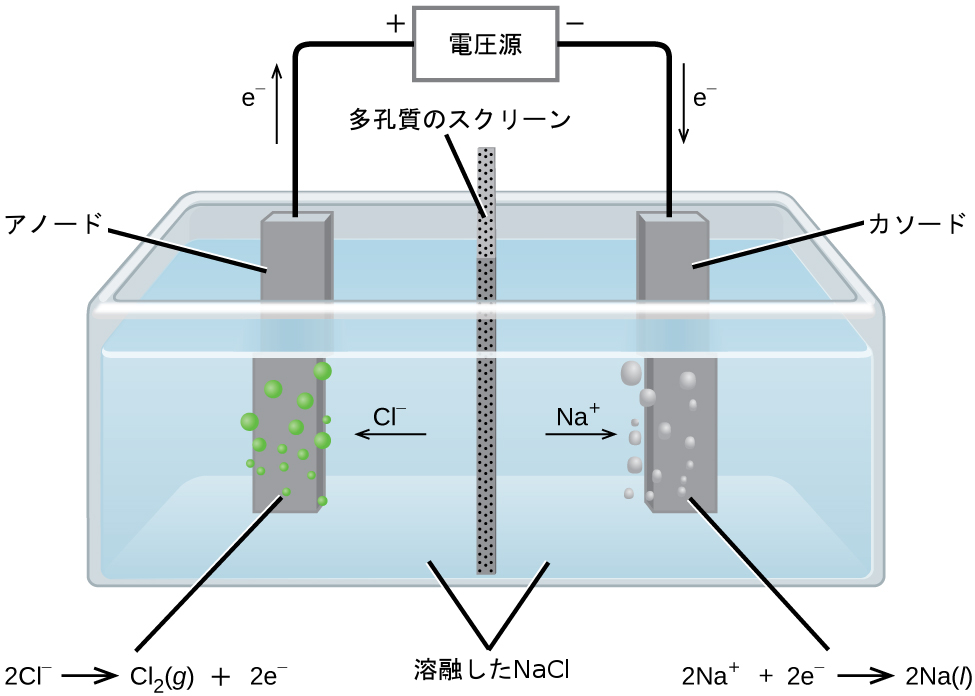
図17.18 | この種の電池(溶融した塩化ナトリウムの電気分解のための電池)は、ナトリウムと塩素の製造のためのダウンズ法で使用されており、一般的には鉄カソードと炭素アノードを使用しています。
水の電気分解
水は、図17.19に図示したものと同様の電池内で電気分解されることがあります。異なる酸化-還元種を導入することなく電気伝導度を向上させるために、典型的には強酸の追加によって水の水素イオン濃度を増加させます。この電池に関連する酸化-還元プロセスは、以下の通りです。
\[ \begin{array}{ll} {\rm アノード: 2H_2 O\ (l) ⟶ O_2\ (g) + 4H^+\ (aq) + 4e^−} \hspace{20pt} E°_{\rm アノード} = {\rm +1.229\ V}\\ {\rm カソード: 2H^+\ (aq) + 2e^− ⟶ H_2\ (g)} \hspace{20pt} E°_{\rm カソード} = {\rm 0\ V}\\ \hline {\rm 電池: 2H_2 O\ (l) ⟶ 2H_2\ (g) + O_2\ (g)} \hspace{20pt} E°_{\rm 電池} = {\rm −1.229\ V}\\ \end{array} \]
やはり、書かれているように電池電位は負であり、+1.229 Vよりも大きい電池電圧を印加することによって駆動されなければならない非自発的な電池反応であることを示しています。この電池は標準状態の条件下では動作していませんが、ここでは熱力学的予測に情報を与えるために標準電極電位が使用されていることを心に留めておいてください。そのため、 計算された電池電位はせいぜい大まかな推定値とみなされるべきです。
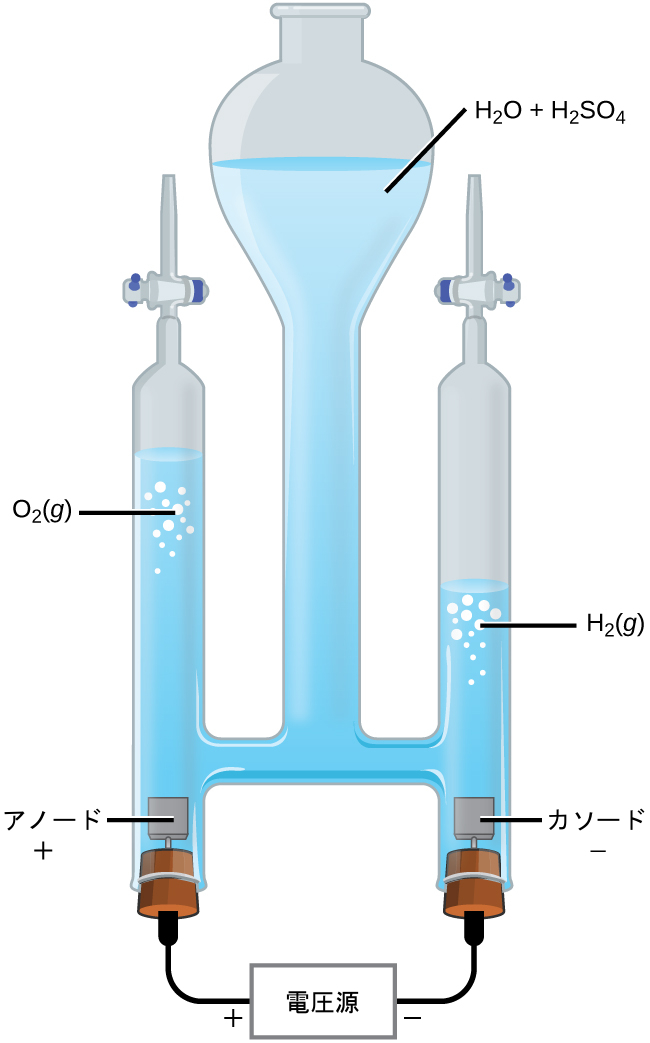
図17.19 | 水の電気分解では、アノードで酸素気体が、カソードで水素が化学量論的な量で生成されます。
水溶性の塩化ナトリウムの電気分解
イオン化合物の水溶液を電気分解する場合、アノード半反応とカソード半反応は、水の種(H₂O、H⁺、OH⁻)または溶質の種(化合物のカチオンとアニオン)のいずれかの電気分解を伴うことがあります。例として、水溶性の塩化ナトリウムの電気分解は、これらの2つのアノード反応のいずれかを含むことがあります:
\[ \begin{array}{ll} {\rm (i)\ 2Cl^−\ (aq) ⟶ Cl_2\ (g) + 2 e^−} \hspace{20pt} &E°_{アノード} = {\rm +1.35827\ V}\\ {\rm (ii)\ 2H_2 O\ (l) ⟶ O_2\ (g) + 4H^+\ (aq) + 4e^−} \hspace{20pt} &E°_{アノード} = {\rm +1.229\ V}\\ \end{array} \]
これら2つの半反応の標準電極(還元)電位から、水は塩化物イオン(-1.358 V)と比べてより負ではない/より正である電位(-1.229 V)で酸化されるであろうことがわかります。このように、熱力学的には水の方がより容易に酸化されやすいと予測されますが、実際には典型的な条件下では水と塩化物イオンの両方が酸化され、酸素と塩素気体の混合物が生成されることが観察されます。
カソードに注意を転じると、還元の可能性は以下のようになります:
\[ \begin{array}{ll} {\rm (iii)\ 2H^+\ (aq) + 2e^− ⟶ H_2\ (g)} \hspace{20pt} &E°_{カソード} = {\rm 0\ V}\\ {\rm (iv)\ 2H_2 O\ (l) + 2e^− ⟶ H_2\ (g) + 2OH^−\ (aq)} \hspace{20pt} &E°_{カソード} = {\rm −0.8277\ V}\\ {\rm (v)\ Na^+\ (aq) + e^− ⟶ Na\ (s)} \hspace{20pt} &E°_{カソード} = {\rm −2.71\ V}\\ \end{array} \]
これらの標準半反応電位を比較すると、水素イオンの還元が熱力学的に有利であることが示唆されます。しかしながら、中性の塩化ナトリウム水溶液では、水素イオンの濃度は、標準状態での値である1Mをはるかに下回っている(約10⁻⁷M)ため、観察されるカソード反応は、実際には水の還元です。この場合の正味の電池反応は、以下の通りです。
\[ {\rm 電池: 2H_2 O\ (l) + 2Cl^−\ (aq) ⟶ H_2\ (g) + Cl_2\ (g) + 2OH^−\ (aq)} \hspace{20pt} E°_{電池} = {\rm −2.186\ V}\\ \]
この電気分解反応は、産業界で塩素や水酸化ナトリウム(灰汁)を製造するために使用される塩素-アルカリプロセスの一部です。
日常生活の中の化学
電気めっき
電解電池の重要な用途は電気めっきです。電気めっきは、導電性のある表面の上に金属を薄くコーティングします。電気めっきを行う理由には、対象物の腐食耐性を高める、表面を強化する、より魅力的な仕上がりにする、または金属の純度を高めるなどがあります。電気めっきで一般的に使用される金属には、カドミウム、クロム、銅、金、ニッケル、銀、およびスズが含まれます。一般的な消費者製品には、銀めっきや金めっきの食器、クロムめっきの自動車部品、宝飾品などがあります。ここでは、食器の銀めっきを例に挙げてプロセスを説明します(図17.20)。
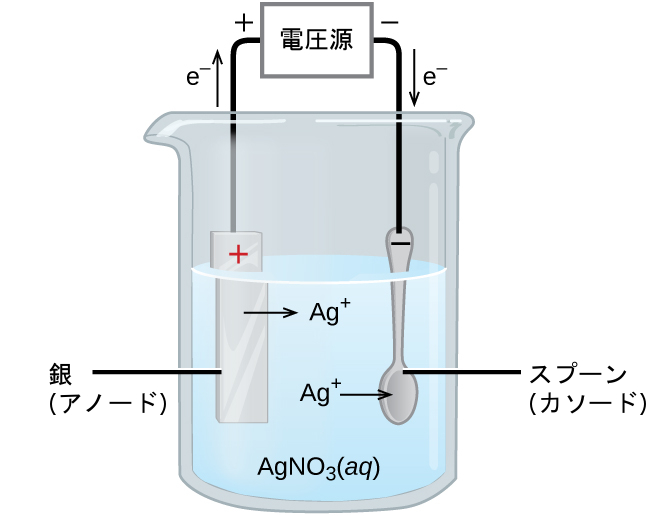
図17.20 | この模式図は、食器の銀めっき用電解電池を示しています。
図中、アノードは左側に示されている銀電極で構成されています。カソードは右側に位置しており、安価な金属製のスプーンです。両方の電極は硝酸銀の溶液に浸されています。十分な電位を印加すると、銀のアノードが酸化され、(スプーンの)カソードで銀イオンが還元されます:
\[ {\rm アノード: Ag\ (s) ⟶ Ag^+\ (aq) + e^−}\\ {\rm カソード: Ag^+\ (aq) + e^− ⟶ Ag\ (s)}\\ \]
正味の結果として、陽極から陰極への金属の銀の移動が起こります。高品質の銀コーティングを得るためには、電解溶液の正確な組成、印加する電池電圧、電解反応の速度(電流)など、いくつかの実験的要因を慎重に制御しなければなりません。
電気分解の定量的側面
電流は、何らかの電荷を帯びた種の流れの速度として定義されます。この議論に最も関連するのは電子の流れです。電流はアンペアと呼ばれる複合単位で測定されます。アンペアは、1クーロン毎秒(A = 1 C/s)として定義されています。指定された時間間隔tにわたって一定の電流Iを流すことによって移動する電荷Qは、単純な数学的積によって与えられます。
\[ Q = It\\ \]
酸化-還元プロセス中に電子が移動する場合、反応の化学量論を使って、関与する(電子)電荷の総量を導出することができます。たとえば、一般的な還元プロセス
\[ {\rm M^{n+}\ (aq) + ne^− ⟶ M\ (s)}\\ \]
は n モルの電子の移動を伴います。したがって、移動する電荷は以下の通りです。
\[ Q = nF\\ \]
ここで、Fはファラデー定数であり、1モルの電子の電荷をクーロンで表したものです。反応が電気化学電池で生じる場合、電流の流れは簡単に測定でき、電池反応に関連した化学量論的計算を助けるために使用することができます。
例題17.9 電流を電子のモル数に変換する
銀の電気めっきのために使用されるあるプロセスでは、10.23Aの電流を電解電池にちょうど1時間流しました。電池を通過した電子のモル数はどれだけですか?硝酸銀溶液からカソードに析出した銀の質量は何ですか?
解法
ファラデー定数を使って、電荷(Q)を電子のモル数(n)に変換することができます。電荷は電流(I)に時間をかけたものです。
\[ n =\frac{Q}{F}=\frac{\frac{\rm 10.23\ C}{\rm s}× {\rm 1\ hr} ×\frac{\rm 60\ min}{\rm hr}×\frac{\rm 60\ s}{\rm min}}{\rm 96485\ C/mol\ e^−}=\frac{\rm 36830\ C}{\rm 96485\ C/mol\ e^−}= {\rm 0.3817\ mol\ e^−}\\ \]
問題から、溶液にはAgNO₃が含まれているので、カソードでの反応は銀1モルに対して1モルの電子が関与しています。
\[ {\rm カソード: Ag^+\ (aq) + e^− ⟶ Ag\ (s)}\\ \]
銀の原子質量は107.9 g/molであるので、以下のようになります。
\[ {\rm Ag\ 質量 = 0.3817\ mol\ e^− ×\frac{1\ mol\ Ag}{1\ mol\ e^−}×\frac{107.9\ g\ Ag}{1\ mol\ Ag}= 41.19\ g\ Ag}\\ \]
学習内容の確認
アルミニウム金属は、電気分解によりアルミニウム(III)イオンから作ることができます。カソードでの半反応は何ですか?溶液に25.0Aの電流を15.0分流した場合、回収される金属アルミニウムの質量は何ですか?
解答:Al³⁺(aq) + 3e⁻ ⟶ Al(s)、0.0777 molのAl = 2.10 gのAl
例題17.10 析出に要する時間
ある用途では、クロム(III)イオンを含む溶液から総表面積3.3 m²の部品に0.010 mmのクロムの層を被覆させなければなりません。電流が33.46Aの場合、クロムの層を析出させるのにどれだけの時間がかかりますか?クロム(金属)の密度は7.19 g/cm³です。
解法
まず、生じさせなければならないクロムの体積(表面積と厚さの積に等しい)を計算します:
\[ {\rm 体積 =\left(0.010\ mm ×\frac{1\ cm}{10\ mm}\right)×\left(3.3\ m^2×\left(\frac{10,000\ cm^2}{1\ m^2}\right)\right)= 33\ cm^3}\\ \]
計算された体積と与えられた密度を使用して、必要なクロムのモル量を計算します:
\[ {\rm 質量 = 体積 × 密度 = 33\ cm^3 ×\frac{7.19\ g}{cm^3}= 237\ g\ Cr}\\ {\rm mol\ Cr = 237\ g\ Cr ×\frac{1\ mol\ Cr}{52.00\ g\ Cr}= 4.56\ mol\ Cr}\\ \]
クロム(III)還元プロセスの化学量論では、生成されるクロム(0)1モルに対して3モルの電子を必要とするため、必要とされる電荷の合計は:
\[ Q = {\rm 4.56\ mol\ Cr ×\frac{3\ mol\ e^−}{1\ mol\ Cr}×\frac{96485\ C}{mol\ e^−}= 1.32 × 10^6\ C}\\ \]
最後に、この電荷を33.46C/sの速度で流すと、所要時間は:
\[ t =\frac{Q}{I}={\rm \frac{1.32 × 10^6\ C}{33.46\ C/s}= 3.95 × 10^4\ s = 11.0\ 時間}\\ \]
学習内容の確認
3.00 m × 5.50 m の鉄板の上面を 0.100 mm の亜鉛の厚さで亜鉛めっきするには、どれだけの質量の亜鉛が必要ですか?亜鉛が Zn(NO₃)₂ の溶液から得られ、電流が 25.5 A の場合、鉄の上面に亜鉛めっきを施すにはどれだけの時間がかかりますか?亜鉛の密度は7.140g/cm³です。
解答:11.8 kgの亜鉛、382時間を必要とする。
重要用語
活性電極:電気化学電池の酸化-還元反応に反応物または生成物として参加する電極。活性電極の質量は酸化-還元反応中に変化する
アルカリ電池:アルカリ(しばしば、水酸化カリウム)電解質を使用する乾電池に似た一次電池。乾電池の改良された代替品となるように設計されており、典型的な乾電池よりもエネルギー貯蔵が多く、電解質の漏出が少ない
アノード:電気化学電池の電極で、酸化が起こる場所
電池(バッテリー):電気力の源として使用するために設計されている単一の、または一連のガルバニ電池
カソード:電気化学電池の電極で、還元が起こる場所
カソード防食:より酸化しやすい金属で構成された犠牲陽極に接続することにより、金属製の対象物の腐食を防止する手法
電池図式(模式図):電気化学電池の構成要素と反応を記号的に表現したもの
電池電位(E電池):カソード半電池とアノード半電池の電位差
濃度電池:同一の組成であるが、1つの酸化-還元反応物または生成物の濃度が異なる半電池からなるガルバニ電池
腐食:自然の電気化学的プロセスによる金属の劣化
乾電池:マンガン(IV)による亜鉛の自発的な酸化に基づいた、亜鉛-炭素電池とも呼ばれることのある一次電池
電極電位(Eₓ):標準水素電極に接続されたときに、関心のある半電池がカソードとして機能する際の電池の電位
電気分解:電気エネルギーを使用して非自発的なプロセスを発生させるプロセス
電解電池:外部電力源を使用して、それがなければ非自発的であるようなプロセスを駆動する電気化学電池
ファラデー定数(F):電子の1モルの電荷、F = 96,485 C/mol e⁻
燃料電池:酸化-還元反応物の連続供給を必要とするガルバニ電池に類似した装置。フロー電池とも呼ばれる
ガルバニ電池(ボルタ電池):自発的な酸化-還元反応が起こる電気化学電池。ボルタ電池とも呼ばれる
亜鉛めっき:より酸化しやすい亜鉛の薄い層でコーティングすることにより、鉄や似たような金属を腐食から保護する方法
半電池:単一反応物の酸化-還元共役対(「カップル」)を含む電池の構成要素
不活性電極:半電池内の反応物との間で電子を伝導するが、それ自体は酸化も還元もされない電極
鉛酸蓄電池:自動車で一般的に使用される再充電可能な電池。典型的には、酸性溶液内のPbの半反応に基づく6つのガルバニ電池からなる
リチウムイオン電池:アノードとカソード間のリチウムイオン移動に基づく、携帯用電子機器で一般的に使用される広い用途の再充電可能な電池
ネルンストの式:酸化-還元系の電位と、その組成とを関連付ける
ニッケル-カドミウム電池:リチウムイオン電池と同様の用途を持つNi/Cd半電池に基づく再充電可能な電池
一次電池:一度きりの使用に適した再充電不可能な電池
犠牲陽極:容易に酸化される金属(しばしばマグネシウムや亜鉛)から作られた電極で、カソード防食を介して金属製の対象物の腐食を防ぐために使用される
塩橋:不活性の電解質溶液で満たされたチューブ
二次電池:再充電を可能にするように設計された電池
標準電池電位(E°電池):すべての反応物と生成物がその標準状態(気体については1barまたは1atm、溶質については1 M)であり、通常は298.15 Kであるときの電池電位
標準電極電位(E°ₓ):標準条件下(気体については1barまたは1atm、溶質については1 M)で、通常は298.15 Kで測定された電極電位
標準水素電極(SHE):水素イオン生成に基づく半電池で、標準状態の条件下で正確に0Vの電位が割り当てられており、電極電位を測定するための普遍的な基準として使用される
重要な方程式
\(•E °_{電池} = E °_{カソード} − E °_{アノード}\)
\(•E °_{電池} = \frac{RT}{nF}\ln K\)
\(•E °_{電池} =\frac{\rm 0.0257\ V}{n}\ln K =\frac{\rm 0.0592\ V}{n}\log K\ (298.15\ Kで)\)
\(•E_{電池} = E °_{電池} −\frac{RT}{nF}\ln Q\ (ネルンストの式)\)
\(•E_{電池} = E °_{電池} −\frac{\rm 0.0592\ V}{n}\log Q\ (298.15\ Kで)\)
\(•ΔG = −nFE_{電池}\)
\(•ΔG° = −nFE°_{電池}\)
\(•w_{電子} = w_{\rm max} = −nFE_{電池}\)
\(•Q = I × t = n × F\)
この章のまとめ
17.1 酸化-還元化学の復習
酸化-還元反応は反応物の酸化数の変化によって定義されるものであり、電気化学に最も関連する反応は実際の電子の移動を伴います。水溶液の相の酸化-還元反応では、酸化剤と還元剤に加えて、水(すなわち、その特徴的なイオンであるH⁺とOH⁻)がしばしば反応物として関与し、これらの反応を表す反応式のバランスをとるのが難しい場合があります。半反応法は、酸化半反応と還元半反応を別々に処理することで、このような反応式のバランスを取るための体系的なアプローチです。
17.2 ガルバニ電池
ガルバニ電池は、酸化剤と還元剤の酸化-還元対が別々の半電池に含まれるように構成されて、自発的な酸化-還元反応が間接的に起こるような装置です。電子は、外部回路を介して(アノード半電池内の)還元剤から(カソード半電池内の)酸化剤へと移動され、不活性な溶液相イオンは、電荷の中立性を維持するために、塩橋を介して半電池間で移動されます。ガルバニ電池の構造と構成は、化学式やその他の記号を使用して、電池模式図(電池図式)の形で簡潔に表現することができます。
17.3 電極電位と電池電位
電位Eの性質とは、電荷の分離/移動に関連するエネルギーです。電気化学では、電池と半電池の電位は、その酸化-還元過程の駆動力または自発性を反映する熱力学的な量です。電気化学電池の電池電位は、カソードとアノード間の差です。半電池の電位データを簡単に共有できるようにするために、標準水素電極(SHE)には正確に0Vの電位が割り当てられ、任意の半電池の単一の電極電位を定義するために使用されます。ある半電池の電極電位Eₓとは、アノードとして動作するSHEに接続されたときに、カソードとして動作するその半電池の電池電位のことです。半電池が標準状態の条件下で動作している場合、その電位は標準電極電位E°ₓです。標準電極電位は、半反応の反応物の相対的な酸化の強さを反映しており、より強い酸化剤ほど、より大きな(より正の)E°ₓの値を示します。標準電極電位の表は、多くの酸化-還元反応の標準電池電位E°電池を計算するのに使用することができます。電池電位の算術符号は、電池反応の自発性を示しており、正の値では自発的な反応、負の値では非自発的な反応(逆方向に自発的)となります。
17.4 電位、自由エネルギー、および平衡
電位は、酸化-還元過程の内在的な駆動力を反映した熱力学的量であり、プロセスの自由エネルギー変化と平衡定数に直接関係しています。電気化学電池で行われる酸化-還元反応では、系が行う最大の(電気的な)仕事は、電池電位と反応の化学量論から簡単に計算でき、プロセスの自由エネルギー変化と等しくなります。酸化-還元反応の平衡定数は、反応の電池電位と対数的に関係しており、電位が大きい(より正である)ことは、反応が完了に向かってはるかに進んだ(Kの値が大きい)ときに平衡化するような、より大きな駆動力を持つ反応を示しています。最後に、酸化-還元反応の電位は反応混合物の組成によって変化し、ネルンストの式によって記述されるように、反応の標準電位とその反応商Qの値に関連しています。
17.5 電池と燃料電池
電気力の供給源として機能するように特別に設計されたガルバニ電池は、電池(バッテリー)と呼ばれています。一度きりの使用の電池(一次電池)と再充電可能な電池(二次電池)の両方についてさまざまなものが市販されており、電圧、大きさ、寿命などの重要な仕様に基づいて、さまざまな用途に使用されています。燃料電池(フロー電池と呼ばれることもあります)は、通常は燃焼プロセスに関連する自発的な酸化-還元反応のエネルギーを利用する装置です。バッテリーと同様に、燃料電池は外部回路を介して反応による電子の移動を可能にしますが、外部容器からの酸化-還元反応物(燃料と酸化剤)の継続的な投入を必要とします。燃料電池は、内燃機関と比較して、反応によって放出されたエネルギーを有用な仕事に変換する際に、一般的にはるかに効率的です。
17.6 腐食
自然な電気化学過程による金属の自発的な酸化は腐食と呼ばれ、鉄の錆や銀の変色などの身近な例があります。腐食プロセスでは、金属製の対象物の異なる部位がアノードとカソードとして機能するガルバニ電池が形成され、腐食はアノードの部位で起こります。金属の腐食を防ぐためのアプローチには、亜鉛の保護コーティングの使用(亜鉛めっき)や、金属製の対象物に接続された犠牲陽極の使用(カソード防食)などがあります。
17.7 電気分解
電気化学電池では、外部電源を使用して適切な電位を印加することによって、非自発的な酸化-還元プロセスが強制的に生じることがあります。これは、電気分解として知られているプロセスです。電気分解は、特定の鉱石の精錬プロセス、多くの化学製品の工業生産、およびさまざまな製品の金属コーティングの電気めっきの基礎となっています。電気分解中の電流の流れを測定することで、化学量論的な計算が可能になります。
練習問題
17.1 酸化-還元化学の復習
1.以下のそれぞれの半反応が、酸化または還元のいずれであるかを特定してください。
(a)Fe³⁺ + 3e⁻ ⟶ Fe
(b)Cr ⟶ Cr³⁺ + 3e⁻
(c)MnO₄²⁻ ⟶ MnO₄⁻ + e⁻
(d)Li⁺ + e⁻ ⟶ Li
2.以下のそれぞれの半反応が、酸化または還元のいずれであるかを特定してください。
(a)Cl⁻ ⟶ Cl₂
(b)Mn²⁺ ⟶ MnO₂
(c)H₂ ⟶ H⁺
(d)NO₃⁻ ⟶ NO
3.以下のそれぞれの半反応の対が酸性溶液中で起こると仮定して、全体の反応についてのバランスの取れた反応式を書いてください。
(a)Ca ⟶ Ca²⁺ + 2e⁻、F₂ + 2e⁻ ⟶ 2F⁻
(b)Li ⟶ Li⁺ + e⁻、Cl₂ + 2e⁻ ⟶ 2Cl⁻
(c)Fe ⟶ Fe³⁺ + 3e⁻、Br₂ + 2e⁻ ⟶ 2Br⁻
(d)Ag ⟶ Ag⁺ + e⁻、MnO₄⁻ + 4H⁺ + 3e⁻ ⟶ MnO₂ + 2H₂O
4.それぞれが酸性溶液中で起こると仮定して、以下の反応式のバランスを取ってください。
(a)H₂O₂ + Sn²⁺ ⟶ H₂O + Sn⁴⁺
(b)PbO₂ + Hg ⟶ Hg₂²⁺ + Pb²⁺
(c)Al + Cr₂O₇²⁻ ⟶ Al³⁺ + Cr³⁺
5.練習問題17.4のそれぞれの反応の酸化剤と還元剤を特定してください。
6.それぞれが塩基性溶液中で起こると仮定して、以下の反応式のバランスを取ってください。
(a)SO₃²⁻(aq) + Cu(OH)₂(s) ⟶ SO₄²⁻(aq) + Cu(OH)(s)
(b)O₂(g) + Mn(OH)₂(s) ⟶ MnO₂(s)
(c)NO₃⁻(aq) + H₂(g) ⟶ NO(g)
(d)Al(s) + CrO₄²⁻(aq) ⟶ Al(OH)₃(s) + Cr(OH)₄⁻(aq)
7.練習問題17.6のそれぞれの反応の酸化剤と還元剤を特定してください。
8.酸性溶液中で起こる半反応の反応式に水酸化物イオンが現れないのはなぜですか?
9.塩基性溶液中で起こる半反応の反応式に水素イオンが現れないのはなぜですか?
10.酸化-還元反応では、なぜ電荷のバランスが取れていなければならないのですか?
17.2 ガルバニ電池
11.必要に応じて白金を不活性電極として用いて、以下の電池反応の電池図式を書いてください。
(a)Mg(s) + Ni²⁺(aq) ⟶ Mg²⁺(aq) + Ni(s)
(b)2Ag⁺(aq) + Cu(s) ⟶ Cu²⁺(aq) + 2Ag(s)
(c)Mn(s) + Sn(NO₃)₂(aq) ⟶ Mn(NO₃)₂(aq) + Sn(s)
(d)3CuNO₃(aq) + Au(NO₃)₃(aq) ⟶ 3Cu(NO₃)₂(aq) + Au(s)
12.以下の図式に書かれているようにガルバニ電池が表されると仮定して、それぞれにおいて生じる半電池反応を特定してください。
(a)Mg(s) │ Mg²⁺(aq) ║ Cu²⁺(aq) │ Cu(s)
(b)Ni(s) │ Ni²⁺(aq) ║ Ag⁺(aq) │ Ag(s)
13.練習問題17.12のそれぞれの電池の電池反応について、バランスの取れた反応式を書いてください。
14.以下のそれぞれの反応のバランスを取り、ガルバニ電池で起こるであろう反応を表す電池の模式図を書いてください。
(a)Al(s) + Zr⁴⁺(aq) ⟶ Al³⁺(aq) + Zr(s)
(b)Ag⁺(aq) + NO(g) ⟶ Ag(s) + NO₃⁻(aq) (酸性溶液)
(c)SiO₃²⁻(aq) + Mg(s) ⟶ Si(s) + Mg(OH)₂(s) (塩基性溶液)
(d)ClO₃⁻(aq) + MnO₂(s) ⟶ Cl⁻(aq) + MnO₄⁻(aq) (塩基性溶液)
15.練習問題17.14のそれぞれの反応の酸化剤と還元剤を特定してください。
16.与えられた情報から、電池図式を用いて以下の系を記述してください:
(a)一方の半電池では、Pt(NO₃)₂溶液がPt金属を形成し、もう一方の半電池では、Cu金属がCu(NO₃)₂溶液に入ります。すべての溶質濃度は1 Mです。
(b)カソードは 0.55 MのAu(NO₃)₃溶液中の金電極からなり、アノードは 0.75 MのMg(NO₃)₂溶液中のマグネシウム電極です。
(c)一方の半電池は1MのAgNO₃溶液中の銀電極からなり、もう一方の半電池では1MのCu(NO₃)₂溶液中の銅電極が酸化されています。
17.図17.3のようなガルバニ電池に塩橋が必要なのはなぜですか?
18.ある活性(金属)電極は、酸化-還元反応が進むにつれて質量が増加することがわかりました。その電極はアノードですか、カソードですか?説明してください。
19.ある活性(金属)電極は、酸化-還元反応が進むにつれて質量を失うことがわかりました。その電極はアノードですか、カソードですか?説明してください。
20.3つの異なるガルバニ電池の3つの電極(A、B、C)の質量を、電池にしばらく電流を流す前と後に測定しました。電極Aの質量は増加し、電極Bの質量は変化せず、電極Cの質量は減少しました。それぞれの電極が活性か不活性かを特定して、(可能であれば)それがアノードまたはカソードとして機能したかどうかを記載してください。
17.3 電極電位と電池電位
21.以下のそれぞれの反応の標準電池電位を計算し、標準状態の条件下で反応が自発的であるかどうかを記載してください。
(a)Mg(s) + Ni²⁺(aq) ⟶ Mg²⁺(aq) + Ni(s)
(b)2Ag⁺(aq) + Cu(s) ⟶ Cu²⁺(aq) + 2Ag(s)
(c)Mn(s) + Sn(NO₃)₂(aq) ⟶ Mn(NO₃)₂(aq) + Sn(s)
(d)3Fe(NO₃)₂(aq) + Au(NO₃)₃(aq) ⟶ 3Fe(NO₃)₃(aq) + Au(s)
22.以下のそれぞれの反応の標準電池電位を計算し、標準状態の条件下で反応が自発的であるかどうかを記載してください。
(a)Mn(s) + Ni²⁺(aq) ⟶ Mn²⁺(aq) + Ni(s)
(b)3Cu²⁺(aq) + 2Al(s) ⟶ 2Al³⁺(aq) + 3Cu(s)
(c)Na(s) + LiNO₃(aq) ⟶ NaNO₃(aq) + Li(s)
(d)Ca(NO₃)₂(aq) + Ba(s) ⟶ Ba(NO₃)₂(aq) + Ca(s)
23.以下の電池図式についてのバランスの取れた電池反応を書き、標準電池電位を計算し、標準状態の条件下で反応が自発的であるかどうかを記載してください。
Cu(s) │ Cu²⁺(aq) ║ Au³⁺(aq) │ Au(s)
24.銀電極が1Mの硝酸銀溶液の中に入ったカソード半電池と亜鉛電極が1Mの硝酸亜鉛溶液の中に入ったアノード半電池によって構成された電池の25°Cにおける電池反応と標準電池電位を決定してください。この反応は標準条件で自発的でしょうか?
25.カドミウム電極が1Mの硝酸カドミウム溶液の中に入ったカソード半電池とアルミニウム電極が1Mの硝酸アルミニウム溶液の中に入ったアノード半電池によって構成された電池の25°Cにおける電池反応と標準電池電位を決定してください。この反応は標準条件で自発的でしょうか?
26.以下の電池図式についてのバランスの取れた電池反応を書き、標準電池電位を計算し、標準状態の条件下で反応が自発的であるかどうかを記載してください。
Pt(s) │ H₂(g) │ H⁺(aq) ║ Br₂(aq), Br⁻(aq) │ Pt(s)
17.4 電位、自由エネルギー、および平衡
27.以下のそれぞれの標準電池電位と電子の化学量論的な値との組について、対応する標準自由エネルギー変化(kJ)を計算してください。
(a)0.000 V、n = 2
(b)+0.434 V、n = 2
(c)−2.439 V、n = 1
28.以下のそれぞれの標準自由エネルギー変化と電子の化学量論的な値との組について、対応する標準電池電位を計算してください。
(a)12 kJ/mol、n = 3
(b)−45 kJ/mol、n = 1
29.ここに記述されている電気化学反応について、記載された条件下での標準電池電位と電池電位を決定してください。298.15 Kでのそれぞれの条件の組の下で、それぞれの反応が自発的であるか、非自発的であるかを述べてください。
(a)Hg(l) + S²⁻(aq, 0.10 M) + 2Ag⁺(aq, 0.25 M) ⟶ 2Ag(s) + HgS(s)
(b)アルミニウム電極が0.015Mの硝酸アルミニウム溶液の中に入ったアノード半電池と、ニッケル電極が0.25Mの硝酸ニッケル(II)溶液の中に入ったカソード半電池によって構成された電池。
(c)1.0Mの水溶性の臭素を0.11Mの臭素イオンに酸化する半電池と、0.023Mのアルミニウムイオンを金属アルミニウムに還元する半電池によって構成された電池。
30.練習問題17.29の反応のそれぞれについて、ΔGとΔG°を決定してください。
31.付録Lのデータを使用して、以下の反応の平衡定数を計算してください。温度が与えられていない場合は298.15 Kと仮定してください。
(a)AgCl(s) ⇌ Ag⁺(aq) + Cl⁻(aq)
(b)CdS(s) ⇌ Cd²⁺(aq) + S²⁻(aq) (377 Kで)
(c)Hg²⁺(aq) + 4Br⁻(aq) ⇌ [HgBr₄]²⁻(aq)
(d)H₂O(l) ⇌ H⁺(aq) + OH⁻(aq) (25°Cで)
17.5 電池と燃料電池
32.銅電極が1 MのCuSO₄溶液の中に入った半電池と、鉛電極が1 MのPb(NO₃)₂溶液の中に入った半電池によって構成された電池を考えてみましょう。
(a)この電池の標準電池電位は何ですか?
(b)アノードの反応、カソードの反応、全体の反応は何ですか?
(c)乾電池を使用するように設計されたほとんどの装置は、1.0~1.5Vの間で動作します。この電池を使って、乾電池の代わりになる電池を作ることはできますか?その理由は何ですか?
(d)鉛電極のある半電池に硫酸を添加すると、ある程度のPbSO₄(s)が形成されたとします。この電池の電位は増加するでしょうか、減少するでしょうか、変わらないでしょうか?
33.全体の反応:Cu(s) + 2Ag⁺(aq) ⟶ 2Ag(s) + Cu²⁺(aq)を持つ電池を考えてみましょう。
(a)アノードとカソードでの反応は何ですか?
(b)電池は、電池電位がゼロになると「電池切れ」になります。この電池が切れたときのQの値は何ですか?
(c)ある切れた電池が[Cu²⁺] = 0.11 Mである場合、銀イオンの濃度は何ですか?
34.なぜ電池は切れるのに、燃料電池は切れないのでしょうか?
35.いくつかの電池が放電するときに観測される電圧の低下をネルンストの式を使って説明してください。
36.本章のこれまでの情報を用いて、電池駆動の電子機器が低温では性能が低下する理由を説明してください。
17.6 腐食
37.それぞれの金属のペアのうち、腐食(酸化)しやすいのはどちらですか?
(a)MgまたはCa
(b)AuまたはHg
(c)FeまたはZn
(d)AgまたはPt
38.以下の金属を考えてみましょう:Ag、Au、Mg、Ni、Zn。これらの金属のうち、どれがスチール製の地下貯蔵タンクのカソード防食の犠牲陽極として使用できますか?スチールは大部分が鉄で構成された合金なので、スチールの標準還元電位としては-0.447Vを用います。
39.アルミニウム(E°Al³⁺/Al = -2.07 V)は、鉄(E°Fe³⁺/Fe = -0.477 V)よりも酸化されやすいですが、両方が環境にさらされたときには、未処理のアルミニウムは非常に良好な腐食耐性を持っている一方で、未処理の鉄の腐食耐性は悪いです。この観察は何によって説明できるでしょうか?
40.鉄の試料と亜鉛の試料を接触させると、亜鉛は腐食しますが、鉄は腐食しません。鉄の試料と銅の試料を接触させると、鉄は腐食しますが、銅は腐食しません。この現象を説明してください。
41.あなたはA、B、Cの3種類の金属を持っているとします。金属Aと金属Cが接触すると、Bは腐食し、Aは腐食しません。金属Aと金属Cが接触すると、Aは腐食し、Cは腐食しません。この情報をもとにすると、金属Bと金属Cが接触したとき、どちらの金属が腐食し、どちらの金属が腐食しないでしょうか?
42.リチウム金属製の犠牲陽極はなぜまずい選択なのでしょうか?
17.7 電気分解
43.ある回路を2.5Aの電流が35分間流れた場合、どれだけのクーロンの電荷が回路内を移動したでしょうか?
44.練習問題17.43のシナリオでは、どれだけの数の電子が回路内を移動したでしょうか?
45.以下のそれぞれの溶融塩の電気分解時に起こる半反応と電池反応を書いてください。
(a)CaCl₂
(b)LiH
(c)AlCl₃
(d)CrBr₃
46.練習問題17.45のそれぞれの電解電池において、それぞれの電池を合計3.33×10⁵Cの電荷が通過した場合、それぞれの生成物はどれだけの質量が生成されますか?
47.以下のそれぞれのイオンの1モルを、記載されている電流を使って還元するにはどれだけの時間がかかりますか?
(a)Al³⁺、1.234 A
(b)Ca²⁺、22.2 A
(c)Cr⁵⁺、37.45 A
(d)Au³⁺、3.57 A
48.図17.19に示される電池に 2.345 A の電流を 45 分間流します。圧力がちょうど 1 atm の場合、室温で捕集される水素の体積は何ですか?(ヒント:水の上に存在する気体は水素だけですか?)
49.ある合金で作られた不規則な形の金属部品にZn(NO₃)₂溶液を用いて亜鉛めっきを施しました。2.599Aの電流を使用したとき、亜鉛が部品の上に0.01123mmの層を形成するのにちょうど1時間かかりました。その部品の総表面積は何ですか?亜鉛の密度は7.140 g/cm³です。
解答のヒント
1.(a)還元、(b)酸化、(c)酸化、(d)還元
3.(a)F₂ + Ca ⟶ 2F⁻ + Ca²⁺、(b)Cl₂ + 2Li ⟶ 2Li⁺ + 2Cl⁻、(c)3Br₂ + 2Fe ⟶ 2Fe³⁺ + 6Br⁻、(d)MnO₄ + 4H⁺ + 3Ag ⟶ 3Ag⁺ + MnO₂ + 2H₂O
5.酸化される:(a)Sn²⁺、(b)Hg、(c)Al、還元される:(a)H₂O₂、(b)PbO₂、(c)Cr₂O₇²⁻、酸化剤:(a)H₂O₂、(b)PbO₂、(c)Cr₂O₇²⁻、還元剤:(a)Sn²⁺、(b)Hg、(c)Al
7.酸化される = 還元剤:(a)SO₃²⁻、(b)Mn(OH)₂、(c)H₂、(d)Al、還元される = 酸化剤:(a)Cu(OH)₂、(b)O₂、(c)NO₃⁻、(d)CrO₄²⁻
9.塩基性溶液中では、[OH⁻] > 1 × 10⁻⁷M > [H⁺]となります。水素イオンは、その濃度が実質的にゼロであるため、反応物として現れることができません。もし水素イオンが生成されたとしても、それは過剰な水酸化物イオンと瞬時に反応して水を生成します。したがって、水素イオンは塩基性溶液中では反応物や生成物として現れるはずがありません。
11.(a)Mg(s) │ Mg²⁺(aq) ║ Ni²⁺(aq) │ Ni(s)、(b)Cu(s) │ Cu²⁺(aq) ║ Ag⁺(aq) │ Ag(s)、(c)Mn(s) │ Mn²⁺(aq) ║ Sn²⁺(aq) │ Sn(s)、(d)Pt(s) │ Cu⁺(aq), Cu²⁺(aq) ║ Au³⁺(aq) │ Au(s)
13.(a)Mg(s) + Cu²⁺(aq) ⟶ Mg²⁺(aq) + Cu(s)、(b)2Ag⁺(aq) + Ni(s) ⟶ Ni²⁺(aq) + 2Ag(s)
15.酸化される種 = 還元剤:(a)Al(s)、(b)NO(g)、(c)Mg(s)、(d)MnO₂(s)、還元される種 = 酸化剤:(a)Zr⁴⁺(aq)、(b)Ag⁺(aq)、(c)SiO₃²⁻(aq)、(d)ClO₃⁻(aq)
17.塩橋がなければ、回路は開いており(または壊れており)、電流は流れません。塩橋があれば、それぞれの半電池は電気的に中性のままで、回路に電流を流すことができます。
19.活性電極は酸化-還元反応に参加します。金属はカチオンを形成するので、電極中の金属原子が酸化して溶液中に入ると電極は質量を失います。酸化はアノードで起こります。
21.(a)+2.115 V (自発的)、(b)+0.4626 V (自発的)、(c)+1.0589 V (自発的)、(d)+0.727 V (自発的)
23.3Cu(s) + 2Au³⁺(aq) ⟶ 3Cu²⁺(aq) + 2Au(s)、+1.16 V、自発的
25.3Cd(s) + 2Al³⁺(aq) ⟶ 3Cd²⁺(aq) + 2Al(s)、−1.259 V、非自発的
27.(a)0 kJ/mol、(b)−83.7 kJ/mol、(c)+235.3 kJ/mol
29.(a)標準電池電位:1.50 V、自発的、記載された条件下での電池電位:1.43 V、自発的 (b)標準電池電位:1.405 V、自発的、記載された条件下での電池電位:1.423 V、自発的 (c)標準電池電位:−2.749 V、非自発的、記載された条件下での電池電位:−2.757 V、非自発的
31.(a)1.7 × 10⁻¹⁰、(b)2.6 × 10⁻²¹、(c)4.693 × 10²¹、(d) 1.0 × 10⁻¹⁴
33.(a)アノード: Cu(s) ⟶ Cu²⁺(aq) + 2e⁻ E°アノード = 0.34 V カソード:2 × (Ag⁺(aq) + e⁻ ⟶ Ag(s)) E°カソード = 0.7996 V (b) 3.5 × 10¹⁵、(c)5.6 × 10⁻⁹M
34.電池は自己完結型であり、電池切れになる前に消耗する試薬の供給量が限られています。あるいは、電池反応の副生成物が蓄積し、反応を妨害します。燃料電池は常に反応物が再供給され、生成物が排出されるので、試薬が供給される限り機能し続けることができます。
36.E電池は、ネルンストの式で記述されているように、温度に正比例する項を持っています。低温では、この項が減少し、その結果、電池から機器に供給される電池電圧が低下します。これは電池が切れることと同じ効果です。
38.MgとZn
40.両方の例に、カソード防食が関連しています。アノード(犠牲陽極)は、腐食(酸化または反応)する金属です。鉄(-0.447 V)と亜鉛(-0.7618 V)の場合、亜鉛はより負の標準還元電位を持っているので、アノードとして機能します。鉄と銅(0.34V)の場合、鉄は標準還元電位が小さいので、腐食します(アノードとして機能します)。
42.リチウムの還元電位は他の金属を保護することを可能にしますが、この高い電位はリチウムの反応性がどれだけ高いかということも示しています。リチウムはほとんどの物質と自発的に反応します。これは、リチウムが他の物質と素早く反応することを意味し、保護しようとしている金属を酸化しない物質とさえも反応するでしょう。このような反応性は、犠牲陽極が急速に枯渇し、頻繁に交換する必要があることを意味します。(付随的な追加の理由:水の存在下で火災の危険性。)
46.(a)Caの質量 = 69.1 g、Cl₂の質量 = 122 g、(b)Liの質量 = 23.9 g、H₂の質量 = 3.48 g、(c)Alの質量 = 31.0 g、Cl₂の質量 = 122 g、(d)Crの質量 = 59.8 g、Br₂の質量 = 276 g
48.0.79 L
この訳文は元の本のCreative Commons BY 4.0ライセンスに従って同ライセンスにて公開します。問題がありましたら、可能な限り早く対応いたしますので、ご連絡ください。また、誤訳・不適切な表現等ありましたらご指摘ください。この本は、https://openstax.org/details/books/chemistry-2eで無料でダウンロードできます。